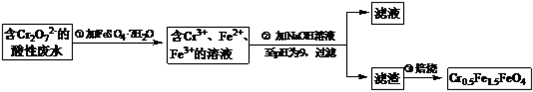题目内容
【题目】粉煤灰(主要含有SiO2、Fe2O3、Al2O3等)是燃煤发电过程中产生的废渣,粉煤灰的综合利用具有很大的价值. Ⅰ.研究人员通过实验对粉煤灰中铝和铁元素的分离工艺进行了研究.
(1)以硫酸溶液分解粉煤灰,使其中的铝、铁元素溶出,过滤实现初步分离. ①写出硫酸溶液与Fe2O3反应的离子方程式 .
②初步分离得到的滤渣主要成分是 .
(2)向(1)分离所得的滤液中加入还原剂使Fe3+转化为Fe2+ , 结合表分析其原因 .
物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 |
沉淀区间(pH) | 7.06~8.95 | 1.94~3.20 | 3.69~4.8 |
(3)使用碱性较弱的氨水为pH调节剂,进行分离实验. ①氨水使滤液中铝离子沉淀的离子方程式为 .
②反应终点的pH对铝和铁分离效果的影响如图1.根据实验结果,为达到好的分离效果,反应过程中控制pH的范围是 , 选择该范围的理由是 .
(4)Ⅱ.NH4HSO4和H2SO4按物质的量比1:1混合配制成浸取液,220℃时,可将高铝粉煤灰中Al2O3转化为硫酸铝铵[NH4Al(SO4)2],然后分离、煅烧获得纯Al2O3 . 已知硫酸铝铵:①溶解度:0℃时,S=5.2g;100℃时,S=421.9g.
②280℃时分解.
1)依据资料可知,将硫酸铝铵与其他溶质分离的方法是 .
2)煅烧NH4Al(SO4)2同时得到混合气体(NH3、N2、SO2、SO3、H2O).若16mol混合气体按图2装置被完全吸收制得浸取液,请将图2中试剂及其物质的量补充完整 .
【答案】
(1)6H++Fe2O3=2Fe3++3H2O;SiO2
(2)Fe(OH)3和Al(OH)3沉淀的pH相近,不易通过沉淀分离
(3)3NH3?H2O+Al3+=Al(OH)3+3NH4+;略小于5;铝元素沉淀较多,铁元素还没有开始大量的沉淀 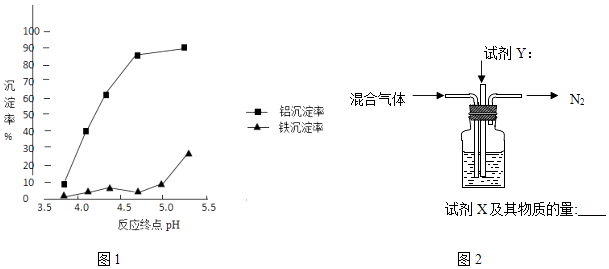
(4)冷却、结晶;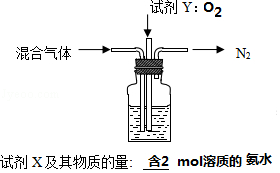
【解析】解:Ⅰ(1)①硫酸溶液与Fe2O3反应的离子方程式为6H++Fe2O3=2Fe3++3H2O,所以答案是:6H++Fe2O3=2Fe3++3H2O;②SiO2不与硫酸反应,则初步分离得到的滤渣主要成分是SiO2 , 所以答案是:SiO2;(2)向(1)分离所得的滤液中加入还原剂使Fe3+转化为Fe2+ , 由表格数据可知,因Fe(OH)3和Al(OH)3沉淀的pH相近,不易通过沉淀分离,所以答案是:Fe(OH)3和Al(OH)3沉淀的pH相近,不易通过沉淀分离;(3)①氨水使滤液中铝离子沉淀的离子方程式为3NH3H2O+Al3+=Al(OH)3+3NH4+ , 所以答案是:3NH3H2O+Al3+=Al(OH)3+3NH4+;②反应终点的pH对铝和铁分离效果的影响如图1.根据实验结果,为达到好的分离效果,反应过程中控制pH的范围是略小于5 (或在4.5~5之间均可),因铝元素沉淀较多,铁元素还没有开始大量的沉淀,所以答案是:略小于5;铝元素沉淀较多,铁元素还没有开始大量的沉淀;Ⅱ.(1)由信息可知,溶解度受温度影响大,则将硫酸铝铵与其他溶质分离的方法是冷却、结晶,所以答案是:冷却、结晶;2)加热时发生4NH4Al(SO4)2 ![]() 2Al2O3+5SO3↑+3SO2↑+2NH3↑+N2↑+5H2O↑,由图可知氮气排出,试剂Y可氧化二氧化硫,试剂X吸收三氧化硫,则试剂Y为O2 , 16mol混合气体含2mol氨气,氧化后由S原子守恒可得到8mol三氧化硫,NH4HSO4和H2SO4按物质的量比1:1混合配制成浸取液,由8SO3~4NH3 , 则试剂X为含2mol溶质的氨水,所以答案是:
2Al2O3+5SO3↑+3SO2↑+2NH3↑+N2↑+5H2O↑,由图可知氮气排出,试剂Y可氧化二氧化硫,试剂X吸收三氧化硫,则试剂Y为O2 , 16mol混合气体含2mol氨气,氧化后由S原子守恒可得到8mol三氧化硫,NH4HSO4和H2SO4按物质的量比1:1混合配制成浸取液,由8SO3~4NH3 , 则试剂X为含2mol溶质的氨水,所以答案是:  .
.

 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案