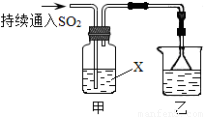题目内容
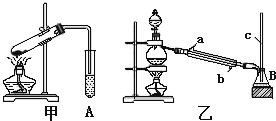
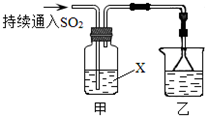 某化学兴趣小组用以下装置探究SO2的某些化学性质.
某化学兴趣小组用以下装置探究SO2的某些化学性质.(1)装置乙的作用是
(2)若X为品红溶液,观察到溶液褪色,说明SO2具有
a.氧化性 b.还原性 c.漂白性
(3)若试剂X为Ca(ClO)2溶液,可观察到白色沉淀生成,完成该过程的离子方程式:
 Ca2++
Ca2++ ClO-+
ClO-+ SO2+
SO2+ H2O=
H2O=
 Cl-+
Cl-+ SO42-+
SO42-+
分析:(1)二氧化硫为有毒气体,需要对二氧化硫进行吸收处理;
(2)二氧化硫具有漂白性,能够使品红溶液褪色;二氧化硫具有氧化性,与Na2S反应生成单质硫,据此进行解答;
(3)生成的白色沉淀为硫酸钙,根据化合价升降相等对该反应进行配平.
(2)二氧化硫具有漂白性,能够使品红溶液褪色;二氧化硫具有氧化性,与Na2S反应生成单质硫,据此进行解答;
(3)生成的白色沉淀为硫酸钙,根据化合价升降相等对该反应进行配平.
解答:解:(1)由于二氧化硫是一种有毒气体,能够污染大气,需要对其完全进行吸收,所以装置乙为尾气处理装置,
故答案为:尾气处理;
(2)若X为品红溶液,观察到溶液褪色,说明二氧化硫具有漂白性,能够漂白品红溶液;若X为Na2S溶液,观察到溶液中出现淡黄色浑浊,淡黄色为单质硫,二氧化硫中S的化合价为+4价,反应变成了0价,二氧化硫的化合价降低被还原,说明二氧化硫具有氧化性,
故答案为:c;a;
(3)Ca(ClO)2与二氧化硫的反应中,二氧化硫被氧化成硫酸根离子,硫酸根离子与钙离子反应生成硫酸钙沉淀;ClO-中Cl的化合价为+1价,反应后变成氯离子,化合价降低了2价,根据硫酸钙的化学式组成可知,次氯酸根离子计量数至少为2,反应化合价至少降低4价;二氧化硫化合价为+4价,反应后变成+6价,化合价升高2价,化合价变化的最小公倍数为4,所以次氯酸离子的计算量为2,二氧化硫的计量数为2,再利用观察法配平,配平后的离子方程式为:Ca2++2ClO-+2SO2+2H2O=CaSO4↓+2Cl-+SO42-+4H+,
故答案为:Ca2++2ClO-+2SO2+2H2O=CaSO4↓+2Cl-+SO42-+4H+.
故答案为:尾气处理;
(2)若X为品红溶液,观察到溶液褪色,说明二氧化硫具有漂白性,能够漂白品红溶液;若X为Na2S溶液,观察到溶液中出现淡黄色浑浊,淡黄色为单质硫,二氧化硫中S的化合价为+4价,反应变成了0价,二氧化硫的化合价降低被还原,说明二氧化硫具有氧化性,
故答案为:c;a;
(3)Ca(ClO)2与二氧化硫的反应中,二氧化硫被氧化成硫酸根离子,硫酸根离子与钙离子反应生成硫酸钙沉淀;ClO-中Cl的化合价为+1价,反应后变成氯离子,化合价降低了2价,根据硫酸钙的化学式组成可知,次氯酸根离子计量数至少为2,反应化合价至少降低4价;二氧化硫化合价为+4价,反应后变成+6价,化合价升高2价,化合价变化的最小公倍数为4,所以次氯酸离子的计算量为2,二氧化硫的计量数为2,再利用观察法配平,配平后的离子方程式为:Ca2++2ClO-+2SO2+2H2O=CaSO4↓+2Cl-+SO42-+4H+,
故答案为:Ca2++2ClO-+2SO2+2H2O=CaSO4↓+2Cl-+SO42-+4H+.
点评:本题考查了二氧化硫的性质、氧化还原反应方程式的配平,题目难度中等,注意掌握二氧化硫具有漂白性、氧化性和还原性,明确配平氧化还原反应方程式的方法.

练习册系列答案
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案
相关题目