题目内容
3.下列有关叙述正确的是( )①因为C和Si是同主族元素,故CO2和SiO2形成的晶体相同
②在晶体中有阳离子就一定有阴离子
③由于水分子间可以形成氢键故水分子的稳定性很强
④在分子晶体中一定不存在离子键,而在离子晶体中可能存在共价键
⑤CaCl2、Na2O2 中既有共价键又有离子键
⑥构成单质分子的微粒中不一定含有化学键.
| A. | ①② | B. | ②③ | C. | ③⑤ | D. | ④⑥ |
分析 ①CO2和SiO2分别为分子晶体、原子晶体;
②金属晶体中不含阴离子;
③稳定性与化学键有关,氢键只影响物理性质;
④含离子键的一定为离子晶体,可能含化学键;
⑤CaCl2只含离子键;
⑥构成单质分子的微粒,如稀有气体不含化学键,多原子分子中含化学键.
解答 解:①CO2和SiO2分别为分子晶体、原子晶体,与C、Si同主族无关,故错误;
②金属晶体中不含阴离子,离子晶体中含阳离子、阴离子,故错误;
③稳定性与化学键有关,氢键只影响物理性质,则水分子间可以形成氢键使其沸点高,故错误;
④含离子键的一定为离子晶体,可能含化学键,分子晶体中一定不存在离子键,离子晶体可存在离子键、共价键,如NaOH,故正确;
⑤CaCl2只含离子键,Na2O2 中既有共价键又有离子键,故错误;
⑥构成单质分子的微粒,如稀有气体不含化学键,多原子分子中含化学键,则单质分子的微粒中不一定含有化学键,故正确;
故选D.
点评 本题考查晶体类型及结构,为高频考点,把握物质中的化学键、晶体类型为解答的关键,侧重分析与应用能力的考查,注意结合实例分析,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.CuI是一种不溶于水的白色固体,它可由反应:2Cu2++4I-=2CuI↓+I2而得到.现用铜片、石墨作电极,电解KI溶液制取CuI.为确认反应情况,通电前在溶液中又加入了少量酚酞试液和淀粉溶液.电解一段时间后得到白色沉淀,同时阴极区溶液变红,阳极区溶液变蓝.下列说法正确的是( )
| A. | 铜片做阴极,石墨做阳极 | |
| B. | 白色沉淀在阴极附近生成 | |
| C. | 阳极区溶液变蓝的原因是:2Cu+4I--4e-═2CuI↓+I2,碘遇淀粉变蓝 | |
| D. | 阳极区溶液变蓝的原因是:4OH--4e-═2H2O+O2↑,O2将I-氧化为I2,碘遇淀粉变蓝 |
14.以下说法正确的是( )
| A. | 苏打和小苏打焰色反应的现象是相同的,说明在灼烧过程中它们发生了相同的化学变化 | |
| B. | CaCO3难溶于水,而Ca(HCO3)2易溶于水,因此NaHCO3和Na2CO3的溶解度关系为:NaHCO3>Na2CO3 | |
| C. | 将铝箔在酒精灯上加热,可观察到铝箔熔化但不掉落,原因是表面形成了高熔点的氧化膜 | |
| D. | 油条中可添加明矾,说明明矾对人体是无害的 |
11.下列关于“反应先后顺序”的评价中正确的是( )
| A. | 足量铜与一定量浓硫酸加热反应,先产生二氧化硫,后产生氢气 | |
| B. | 向Ba(OH)2溶液中通CO2至过量,先生成白色沉淀,后沉淀溶解 | |
| C. | 向(NH4)2Fe(SO4)2溶液中滴加少量NaOH溶液,NH4+先发生反应 | |
| D. | 向等浓度的FeCl3和CuCl2混合溶液中加入少量Fe粉,Cu2+先被还原 |
18.下列各组中的性质比较正确的是( )
| A. | 稳定性:NH3<PH3<SiH4 | B. | 酸性:H3PO4>H2SO4>HClO4 | ||
| C. | 碱性:KOH<NaOH<Mg(OH)2 | D. | 还原性:Br->Cl->F- |
15.下列电子式书写错误的是( )
| A. |  | B. |  | C. | 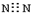 | D. |  |
18.比较下列各组物质的沸点,结论正确的是( )
①丙烷<乙醇②正戊烷>正丁烷③乙醇>乙二醇.
①丙烷<乙醇②正戊烷>正丁烷③乙醇>乙二醇.
| A. | ①② | B. | ②③ | C. | ①③ | D. | ①②③ |
 ,其化学键属极性共价键(填“极性”或“非极性”).
,其化学键属极性共价键(填“极性”或“非极性”).