题目内容
【题目】CO、SO2是主要的大气污染气体,利用化学反应原理是治理污染的重要方法.
Ⅰ.甲醇可以补充和部分替代石油燃料,缓解能源紧张,利用CO可以合成甲醇.
(1)已知:CO(g)+1/2O2(g)═CO2(g)ΔH1=-283.0kJ·mol-1
H2(g)+1/2O2(g)═H2O(l)ΔH2=-285.8kJ·mol-1
CH3OH(g)+3/2O2(g)═CO2(g)+2H2O(l)ΔH3=-764.6 kJ·mol-1
请写出CO与H2合成甲醇蒸汽的热化学方程式____________________
(2)一定条件下,在溶剂为VL的密闭容器中充入a molCO与2a molH2合成甲醇,平衡转化率与温度、压强的关系如图所示.

①该反应在A点的平衡常数K=_________________(用a和V表示)
②下列能说明反应达到平衡状态的是_____
A.v(CO)=v(H2) B.混合气体的密度不变
C.混合气体的平均相对分子质量不变 D. c(CO)=c(H2)
③写出能增大v(CO)又能提高CO转化率的一项措施_____________________________
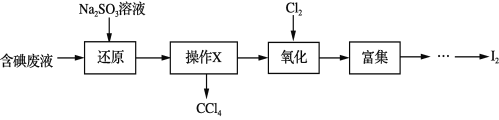
Ⅱ.某学习小组以SO2为原料,采用电化学方法制取硫酸。
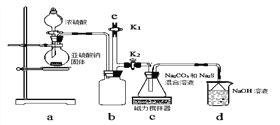
(3)原电池原理:该小组设计的原理示意图如左下图,写出该电池负极的电极反应式______。
(4)电解原理:该小组用Na2SO3溶液充分吸收SO2得到NaHSO3溶液,然后电解该溶液制得了硫酸。原理如图,写出开始电解时阳极的电极反应式________________。


(5)已知25℃时由Na2SO3和NaHSO3形成的混合溶液恰好呈中性,则该混合溶液中各离子浓度的大小顺序为________________________________(已知25℃时,H2SO3的电离平衡常数Ka1=1×10-2,Ka2=1×10-7)
【答案】CO(g)+2H2(g)===CH3OH(g)△H=-90.1 kJ/mol![]() C压缩容器体积或增大体系压强SO2-2e-+2H2O==SO42-+4H+HSO3--2e-+H2O=SO42-+3H+c(Na+)> c(HSO3-)= c(SO32-)> c(OH-)= c(H+)
C压缩容器体积或增大体系压强SO2-2e-+2H2O==SO42-+4H+HSO3--2e-+H2O=SO42-+3H+c(Na+)> c(HSO3-)= c(SO32-)> c(OH-)= c(H+)
【解析】
(1) ①CO(g)+1/2O2(g)═CO2(g)ΔH1=-283.0kJ·mol-1,②H2(g)+1/2O2(g)═H2O(l)ΔH2=-285.8kJ·mol-1,③CH3OH(g)+3/2O2(g)═CO2(g)+2H2O(l)ΔH3=-764.6 kJ·mol-1,由盖斯定律分析,①+②×2-③得
CO(g)+2H2(g)===CH3OH(g)△H=(-283.0-285.8×2+764.5)=-90.1 kJ/mol .
(2) CO(g)+2H2(g)===CH3OH
起始a 2a 0
改变0.75a 1.5a 0.75a
平衡 0.25a 0.5a 0.75a
平衡常数K= ![]() =
=  =
= ![]() 。 (3) A.v(CO)=v(H2) 中不能反映正逆反应速率的关系,不能确定平衡状态,故错误;B.反应体系都为气体,在体积不变的情况下,混合气体的密度始终不变,故不能说明反应到平衡,故错误;C.混合气体的平均相对分子质量=混合气体的总质量/混合气体的总物质的量,因为混合气体的总质量不变,但是混合气体的物质的量随着时间改变而改变,所以当混合气体的平均相对分子质量不变,可以说明反应到平衡,故正确; D. c(CO)=c(H2)不能说明反应到平衡,故错误。故选C。 (4) 压缩容器体积或增大体系压强能增大v(CO)又能提高CO转化率。 (5)该原电池中,负极上失去电子被氧化,二氧化硫到硫酸,硫的化合价升高,所以负极上投放的气体是二氧化硫,二氧化硫失去电子和水反应生成硫酸,电极反应为 SO2-2e-+2H2O==SO42-+4H+。 (6)电解池中阳极和电源的正极相连,失去电子发生氧化反应,电解亚硫酸氢钠溶液可制得硫酸,硫的化合价升高,所以阳极室亚硫酸氢根离子溶液失去电子被氧化生成硫酸根离子,电极反应为:HSO3--2e-+H2O=SO42-+3H+ 。 (7) 已知25℃时,H2SO3的电离平衡常数Ka1=1×10-2,Ka2=1×10-7,可知亚硫酸根离子的水解常数为
。 (3) A.v(CO)=v(H2) 中不能反映正逆反应速率的关系,不能确定平衡状态,故错误;B.反应体系都为气体,在体积不变的情况下,混合气体的密度始终不变,故不能说明反应到平衡,故错误;C.混合气体的平均相对分子质量=混合气体的总质量/混合气体的总物质的量,因为混合气体的总质量不变,但是混合气体的物质的量随着时间改变而改变,所以当混合气体的平均相对分子质量不变,可以说明反应到平衡,故正确; D. c(CO)=c(H2)不能说明反应到平衡,故错误。故选C。 (4) 压缩容器体积或增大体系压强能增大v(CO)又能提高CO转化率。 (5)该原电池中,负极上失去电子被氧化,二氧化硫到硫酸,硫的化合价升高,所以负极上投放的气体是二氧化硫,二氧化硫失去电子和水反应生成硫酸,电极反应为 SO2-2e-+2H2O==SO42-+4H+。 (6)电解池中阳极和电源的正极相连,失去电子发生氧化反应,电解亚硫酸氢钠溶液可制得硫酸,硫的化合价升高,所以阳极室亚硫酸氢根离子溶液失去电子被氧化生成硫酸根离子,电极反应为:HSO3--2e-+H2O=SO42-+3H+ 。 (7) 已知25℃时,H2SO3的电离平衡常数Ka1=1×10-2,Ka2=1×10-7,可知亚硫酸根离子的水解常数为![]() ,可知亚硫酸钠的水解和亚硫酸氢钠的电离程度相等,则知道由亚硫酸钠和亚硫酸氢钠形成的混合溶液恰好呈中性,可知亚硫酸根离子和亚硫酸氢根离子浓度相等,则溶液中的离子浓度关系为: c(Na+)> c(HSO3-)= c(SO32-)> c(OH-)= c(H+)。
,可知亚硫酸钠的水解和亚硫酸氢钠的电离程度相等,则知道由亚硫酸钠和亚硫酸氢钠形成的混合溶液恰好呈中性,可知亚硫酸根离子和亚硫酸氢根离子浓度相等,则溶液中的离子浓度关系为: c(Na+)> c(HSO3-)= c(SO32-)> c(OH-)= c(H+)。