题目内容
【题目】足量锌与浓H2SO4充分在加热下反应生成会SO2和H2的混合气体;锌和稀硫酸反应只有H2生成。现有甲乙两研究小组分别实验探究:
甲研究小组按下图实验验证锌与浓硫酸反应生成物中SO2和H2,取少量的Zn置于b中,向a中加入100mL 18.5mol·L-1的浓硫酸,经过一段时间反应,Zn完全溶解
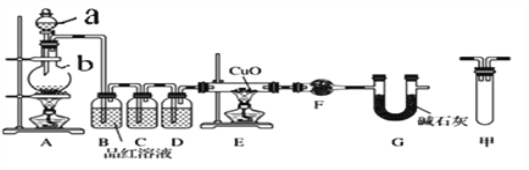
(1)填写仪器名称:a_______________。
(2)写出装置A中生成能使品红溶液褪色的化学反应方程式:_________________。
(3)装置D中加入的试剂是__________。
(4)U型管G的作用为______________。
(5)有同学认为A、B间应增加图中的甲装置,该装置的作用为__________。
(6)证明反应生成SO2和H2的实验现象是_________________。
(7)若A中生成标准状况下的气体33.6L,将A反应后的溶液稀释到1L,测得溶液中H+的浓度为0.1 mol·L-1,则稀释液中SO42-的物质的量浓度是_________ mol·L-1
【答案】分液漏斗Zn+2H2SO4(浓)![]() ZnSO4+2H2O+SO2↑浓硫酸防止空气中的水蒸气进入干燥管,干扰实验防止倒吸B中品红褪色,E中有红色物质生成且F中的无水硫酸铜变蓝1.55 mol·L-1
ZnSO4+2H2O+SO2↑浓硫酸防止空气中的水蒸气进入干燥管,干扰实验防止倒吸B中品红褪色,E中有红色物质生成且F中的无水硫酸铜变蓝1.55 mol·L-1
【解析】
A是制取气体的装置,制备的气体中有二氧化硫、氢气、水蒸汽,B装置是除去二氧化硫,可以用氢氧化钠等碱液吸收;C装置是检验二氧化硫是否除尽,D装置是浓硫酸,吸水干燥作用;E装置是用还原性气体还原氧化铜,F装置无水硫酸铜,检验是否有水生成;G是防止空气中H2O进入干燥管而影响杂质气体的检验。
(1)结合仪器图形和作用得到名称;
(2)装置A中生成能使品红溶液褪色的气体为二氧化硫,是锌和浓硫酸反应得到硫酸锌、二氧化硫和水;
(3)③是对气体进行干燥的试剂为浓硫酸;
(4)G是防止空气中H2O进入干燥管而影响杂质气体的检验;
(5)A、B间应增加图中的甲装置是安全瓶;
(6)B装置是检验二氧化硫,B中品红褪色,证明反应生成SO2;E装置是用还原性气体还原氧化铜,F装置无水硫酸铜,检验是否有水生成;
(7)反应后的溶液稀释到1L,测得氢离子浓度为0.1mol·L-1,稀释后硫酸的浓度为0.05mol·L-1,反应剩余的硫酸为0.05mol×1L=0.05mol,则反应后溶液中硫酸的物质的量浓度为0.05mol×1L/0.1L=0.5mol·L-1,为稀硫酸,故发生反应:Zn+2H2SO4(浓)![]() ZnSO4+SO2↑+H2O、Zn+H2SO4=ZnSO4+H2↑,生成的气体为SO2、H2混合气体,令混合气体中SO2、H2的物质的量分别为xmol、ymol,根据二者体积与消耗硫酸的物质的量列方程计算;
ZnSO4+SO2↑+H2O、Zn+H2SO4=ZnSO4+H2↑,生成的气体为SO2、H2混合气体,令混合气体中SO2、H2的物质的量分别为xmol、ymol,根据二者体积与消耗硫酸的物质的量列方程计算;
(1)①装置图中仪器a为分液漏斗;
(2)装置A中生成能使品红溶液褪色的气体为二氧化硫,是锌和浓硫酸反应得到硫酸锌、二氧化硫和水;
(3)D装置是浓硫酸,吸水干燥作用,
(4)G装置中的碱石灰是防止空气中H2O进入干燥管而影响杂质气体的检验,干扰实验,
(5)A、B间应增加图中的甲装置,是为了防止B装置中的液体倒吸
(6)B装置是检验二氧化硫,B中品红褪色,证明反应生成SO2;E装置是用还原性气体还原氧化铜,F装置无水硫酸铜,检验是否有水生成,只要黑色变红色,无水硫酸铜变蓝色,证明反应生成氢气;
(7)反应后的溶液稀释到1L,氢离子浓度为0.1mol·L-1,稀释后硫酸的浓度为0.05mol·L-1,则反应后溶液中硫酸的物质的量浓度为0.05mol×1L/0.1L=0.5mol·L-1,为稀硫酸,故发生反应:Zn+2H2SO4(浓)![]() ZnSO4+SO2↑+H2O、Zn+H2SO4=ZnSO4+H2↑,生成的气体为SO2、H2混合气体,物质的量为=33.6L/22.4L·mol-1=1.5mol,参加反应的n(H2SO4)=0.1L×18.5mol·L-1-0.05mol×1L=1.8mol,令混合气体中SO2、H2的物质的量分别为xmol、ymol,则:
ZnSO4+SO2↑+H2O、Zn+H2SO4=ZnSO4+H2↑,生成的气体为SO2、H2混合气体,物质的量为=33.6L/22.4L·mol-1=1.5mol,参加反应的n(H2SO4)=0.1L×18.5mol·L-1-0.05mol×1L=1.8mol,令混合气体中SO2、H2的物质的量分别为xmol、ymol,则:
Zn+2H2SO4((浓)![]() ZnSO4+SO2↑+H2O
ZnSO4+SO2↑+H2O
x 2x x
Zn+H2SO4(稀)=ZnSO4+H2↑
y y y
x+y=1.5
2x+y=1.8
解之得 x=0.3,y=1.2
根据原子守恒反应后溶液中SO42- 为n(浓硫酸)-n(SO2)=0.1L×18.5mol·L-1-0.3mol=1.55mol.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案