题目内容
【题目】⑴如图是“×××”牌饮用矿泉水标签的部分内容。
××× (饮用矿泉水) 净含量:350mL 配料表:纯净水、硫酸镁、氯化钾 保质期:12个月 主要成分:钾离子(K+):1.0~27.3mg/L 镁离子(Mg2+):0.1~4.8mg/L 氯离子(Cl-):10~27.3mg/L 硫酸根离子(SO42-):0.4~19.5mg/L |
请认真阅读标签内容,计算:
①镁离子的物质的量浓度的最大值为_____________。
②一瓶合格的这种矿泉水中SO42-的物质的量不能超过_______ 。
⑵某物质A在一定条件下加热分解,产物都是气体,分解方程式为:2A![]() B↑+2C↑+2D↑。测得生成的混合气体对氢气的相对密度为d,则A的相对分子质量为__________。
B↑+2C↑+2D↑。测得生成的混合气体对氢气的相对密度为d,则A的相对分子质量为__________。
【答案】⑴①2×10-4mol/L;②7.1×10-5mol/L;⑵5d;
【解析】
试题分析:(1)①1L矿泉水中镁离子的最大质量为4.9mg,物质的量为![]() =
=![]() mol,镁离子的物质的量浓度的最大值为
mol,镁离子的物质的量浓度的最大值为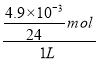 =2.0×10-4mol/L,故答案为:2.0×10-4mol/L;
=2.0×10-4mol/L,故答案为:2.0×10-4mol/L;
②350ml矿泉水中含有硫酸根离子的最大质量为0.35L×19.5mg/L=6.825mg,硫酸根离子的物质的量最大为:n=![]() =
=![]() =7.1×10-5mol,故答案为:7.1×10-5mol;
=7.1×10-5mol,故答案为:7.1×10-5mol;
(2)相同条件下,气体的密度之比等于其摩尔质量之比,生成的混合气体对氢气的相对密度为d,则混合气体的平均摩尔质量为2dg/mol,假设有2molA反应则生成1molB、2molC、2molD,生成物的质量=2dg/mol×(1+2+2)mol=10dg,反应前后质量不变,则A的质量为10dg,其摩尔质量=![]() =5dg/mol,摩尔质量在数值上等于其相对分子质量,所以A的相对分子质量为5d,故答案为:5d。
=5dg/mol,摩尔质量在数值上等于其相对分子质量,所以A的相对分子质量为5d,故答案为:5d。

 考前必练系列答案
考前必练系列答案