题目内容
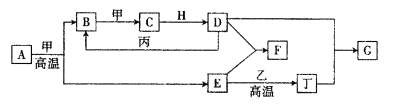
【题目】石膏转化为硫酸钾和CaCl2的工艺流程如下:
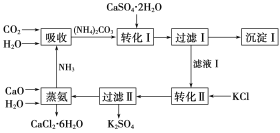
(1)CO2是一种很重要的副产品,工业上获得CO2的途径是_____(用化学方程式表示)。
(2)转化Ⅰ中发生反应的离子方程式为______,过滤Ⅰ得到的滤渣的主要成分是_____。过滤Ⅰ得到的滤液是______,检验滤液中含有CO32-的方法是_______________。
(3)转化Ⅱ中发生反应的化学方程式为_____,转化Ⅱ中可获得K2SO4的原因是___________。
(4)上述工艺流程中体现绿色化学理念的是__________________________。
(5)氯化钙结晶水合物是目前常用的无机储热材料,选择的依据是____。
a.熔点较低(29 ℃熔化) b.能制冷 c.无毒 d.能导电
【答案】CaCO3![]() CaO+CO2↑ CaSO4+CO32-===CaCO3↓+SO42- CaCO3 (NH4)2SO4 取少量滤液于试管中,滴加稀HCl,若有无色无味能使澄清石灰水变浑浊的气体产生,则证明滤液中含有CO32-,若无明显现象,则滤液中不含CO32- 2KCl+(NH4)2SO4===K2SO4↓+2NH4Cl KCl、(NH4)2SO4、K2SO4、NH4Cl四种物质的溶解度受温度的影响不同 氨在工艺中循环使用、使用的原料无毒(其他合理答案也可) ac
CaO+CO2↑ CaSO4+CO32-===CaCO3↓+SO42- CaCO3 (NH4)2SO4 取少量滤液于试管中,滴加稀HCl,若有无色无味能使澄清石灰水变浑浊的气体产生,则证明滤液中含有CO32-,若无明显现象,则滤液中不含CO32- 2KCl+(NH4)2SO4===K2SO4↓+2NH4Cl KCl、(NH4)2SO4、K2SO4、NH4Cl四种物质的溶解度受温度的影响不同 氨在工艺中循环使用、使用的原料无毒(其他合理答案也可) ac
【解析】
根据流程图进行分析解答:首先是CO2和H2O、NH3反应生成(NH4)2CO3,在加入石膏生成沉淀CaCO3和(NH4)2SO4,过滤后再加入KCl,生成K2SO4和NH4Cl,再加入CaO和水即可得到CaCl2![]() 6H2O。
6H2O。
(1)工业上常利用高温煅烧石灰石的方法制二氧化碳气体,反应的方程式为CaCO3![]() CaO+CO2↑,故答案为:CaCO3
CaO+CO2↑,故答案为:CaCO3![]() CaO+CO2↑。
CaO+CO2↑。
(2)转化I是碳酸铵和石膏悬浊液反应生成CaCO3和(NH4)2SO4,反应的离子方程为CaSO4+CO32-=CaCO3↓+SO42-,过滤I得到的滤渣的主要成分是CaCO3,过滤I得到的滤液是(NH4)2SO4,检验滤液中含有CO32-的方法是:取少量滤液于试管中,滴加稀HCl,若有无色无味能使澄清石灰水变浑浊的气体产生,则证明滤液中含有CO32-;若无明显现象,则滤液中不含CO32-;故答案为:CaCO3;(NH4)2SO4;取少量滤液于试管中,滴加稀HCl,若有无色无味能使澄清石灰水变浑浊的气体产生,则证明滤液中含有CO32-,若无明显现象,则滤液中不含CO32-。
(3)转化I的滤液中的溶质为(NH4)2SO4和KC1的饱和溶液反应得到NH4Cl和K2SO4,反应方程式为2KCl+(NH4)2SO4=K2SO4↓+2NH4Cl;转化II中可获得K2SO4的原因是KCl、(NH4)2SO4、K2SO4、NH4Cl四种物质的溶解度受温度的影响不同,故答案为: 2KCl+(NH4)2SO4=K2SO4↓+2NH4Cl; KCl、(NH4)2SO4、K2SO4、NH4Cl四种物质的溶解度受温度的影响不同。
(4)由绿色化学的特点可知,碳酸钙分解生成CO2和CaO都参与反应,硫酸钙和氯化钾转化为硫酸钾和氯化钙、氨在工艺中循环使用等都达到了原子利用率高,没有有害物质排放到环境中,所以符合绿色化学的特点;故答案为:氨在工艺中循环使用,使用的原料无毒,转化率高。
(5) 无机物类能作为储热的特点:密度大、腐蚀性小、成本低,氯化钙结晶水合物(CaCl2![]() 6H2O) 熔点低易熔化,且无毒腐蚀性小、成本低,所以是目前常用的无机储热材料,故ac符合题意,储热材料与溶解性、能制冷性、导电性无关,故bd不符合题意;答案为ac。
6H2O) 熔点低易熔化,且无毒腐蚀性小、成本低,所以是目前常用的无机储热材料,故ac符合题意,储热材料与溶解性、能制冷性、导电性无关,故bd不符合题意;答案为ac。