题目内容
 在盛有足量A的体积可变密闭容器中通入B,发生反应:A(s)+2B(g)
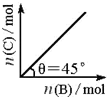
在盛有足量A的体积可变密闭容器中通入B,发生反应:A(s)+2B(g) 5C(g)+D(g);△H>0,在一定温度、压强下达到平衡.平衡时C的物质的量与加入B的物质的量的变化关系如图所示.下列说法中正确的是( )
5C(g)+D(g);△H>0,在一定温度、压强下达到平衡.平衡时C的物质的量与加入B的物质的量的变化关系如图所示.下列说法中正确的是( )分析:根据在一定温度、压强下达到平衡,平衡时C的物质的量与加入B的物质的量的变化关系图可知,平衡时再加入B,因体积可变,则B的浓度不变,则平衡后B的加入平衡不移动;A为纯固体,则加入A不影响化学平衡的移动;该反应是吸热反应,升高温度平衡正向移动,则C的物质的量增加;再由图可知,达平衡时B、C的物质的量相等来计算B的转化率.
解答:解:A、设开始B的物质的量为n,转化的B为x,由图可知,达平衡时B、C的物质的量相等,则(n-x)=2.5x,n=3.5x,则B的转化率为
×100%=28.6%,故A错误;
B、因体积可变,则B的浓度不变,则v(正)、v(逆)都不变,故B错误;
C、因A为纯固体,加入A不影响化学平衡的移动,则B的转化率不变,故C错误;
D、压强一定,当升高温度时,平衡正向移动,则C的物质的量增加,由图可以看出,图中θ>45°,故D正确;
故选:D.
| x |
| 3.5x |
B、因体积可变,则B的浓度不变,则v(正)、v(逆)都不变,故B错误;
C、因A为纯固体,加入A不影响化学平衡的移动,则B的转化率不变,故C错误;
D、压强一定,当升高温度时,平衡正向移动,则C的物质的量增加,由图可以看出,图中θ>45°,故D正确;
故选:D.
点评:本题考查化学平衡的图象分析,明确图象中的纵横坐标的含有及隐含平衡时的信息是解答的关键,并利用影响化学反应速率及化学平衡的影响因素来解答.

练习册系列答案
 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案
相关题目
 (1)实验过程中,一定能观察到的现象有:(所需空白数可根据需要增减)
(1)实验过程中,一定能观察到的现象有:(所需空白数可根据需要增减)



 (1)实验过程中,一定能观察到的现象有:(所需空白数可根据需要增减)
(1)实验过程中,一定能观察到的现象有:(所需空白数可根据需要增减)