题目内容
运用所学的化学反应原理研究化学反应很有意义.请回答下列问题:(1)合成氨原料中的H2可用甲烷在高温下与水蒸气反应制得.部分1mol物质完全燃烧生成常温下稳定氧化物的△H数据如下表:
| 物质 | △H(kJ/mol) |
| H2(g) | -285.8 |
| CO(g) | -283.0 |
| CH4(g) | -890.3 |
(2)500°C、50Mpa时,在容积为VL的定容容器中加入n mol N2、3n mol H2,反应达到平衡后N2的转化率为a.则容器内气体的压强反应前与平衡时的比值为______.
(3)若把标准状况下4.48L氨气通入到100g19.6%的硫酸溶液中,所得溶液中的溶质是______,溶液中离子浓度从大到小的顺序是______.
(4)某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示.有沉淀析出的是______点(填字母).a点对应的Ksp ______c点对应的Ksp (填大于、等于或小于)
(5)以磷酸亚铁锂(LiFePO4)为电极材料的新型锂离子电池具有稳定性高、安全、对环境友好等优点,可用于电动汽车.该锂离子电池在充电过程中,阳极的磷酸亚铁锂生成磷酸铁,则该电池放电时正极的电极反应式为______.

(2)容器内反应前与平衡时气体的压强之比等于物质的量之比;
(3)氨气和酸反应生成对应的盐,根据谁解原理来比较离子浓度的大小;
(4)根据溶度积规则:当Qc大于Ksp时,会有沉淀析出,沉淀溶解平衡曲线上的点均为Qc等于Ksp;
(5)该电池放电时为原电池原理,正极发生还原反应.
解答:解:(1)燃烧热的概念:在25℃,101 kPa时,1 mol可燃物完全燃烧生成稳定的氧化物时所放出的热量叫做该物质的燃烧热,由表格中燃烧热的数据可知,
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ/mol,
H2(g)+
 O2(g)═H2O(l),△H=-285.8KJ/mol;
O2(g)═H2O(l),△H=-285.8KJ/mol;CO(g)+
 O2(g)═CO2(g)△H=-283KJ/mol,
O2(g)═CO2(g)△H=-283KJ/mol,而H2O(g)═H2O(l),△H=44.0kJ/mol,
根据盖斯定律:CH4(g)+H2O(g)═CO(g)+3H2(g)的△H=285.6KJ/mol×3+283KJ/mol+44KJ/mol-890.3KJ/mol=206.1kJ/mol,
故答案为:CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206.1kJ/mol;
(2)根据化学方程式:N2 +3H2
 2NH3,
2NH3,反应前的物质的量 n 3n 0
变化的物质的量 na 3na 2
平衡时的物质的量 n-na 3n-3na 2na
所以:容器内反应前与平衡时气体的物质的量之比=
 =
=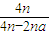 =容器内反应前与平衡时气体的压强之比,故答案为:
=容器内反应前与平衡时气体的压强之比,故答案为: ;
;(3)氨气和酸反应生成对应的盐,4.48L即0.2mol氨气通入到100g19.6%即0.2mol的硫酸溶液中,等物质的量反应生成硫酸氢铵,能电离出等量的铵根、氢离子和硫酸根,但是铵根离子水解使溶液显酸性,离子浓度大小为:c(H+)>c(SO42-)>c(NH+4)>c(OH-),故答案为:NH4HSO4;c(H+)>c(SO42-)>c(NH+4)>c(OH-);
(4)根据溶度积规则:当Qc大于Ksp时,会有沉淀析出,图中b点Qc大于Ksp,所以该点有沉淀析出,a、c点均为Qc等于Ksp,及平衡点,故答案为:b;等于;
(5)电池放电时为原电池原理,正极发生得电子的还原反应,即FePO4+Li++e-═LiFePO4,故答案为:FePO4+Li++e-═LiFePO4.
点评:本题是一道综合性较强的题目,难度较大.考查学生分析和解决问题的能力.

 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案实施以减少能源浪费和降低废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择。化工行业的发展必须符合国家节能减排的总体要求,依靠理论知识做基础。试运用所学知识,解决下列问题:
(1)已知某反应的平衡表达式为: 它所对应的化学反应为:_____________________________
它所对应的化学反应为:_____________________________
(2)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)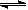 CH3OH(g);ΔH=-90.8 kJ/mol
CH3OH(g);ΔH=-90.8 kJ/mol
②2CH3OH(g)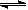 CH3OCH3(g)+H2O(g);ΔH=-23.5 kJ/mol
CH3OCH3(g)+H2O(g);ΔH=-23.5 kJ/mol
③CO(g)+ H2O(g)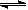 CO2(g)+H2(g);ΔH=-41.3 kJ/mol
CO2(g)+H2(g);ΔH=-41.3 kJ/mol
总反应:3H2(g)+3CO(g) CH3OCH3(g)+CO2(g)的ΔH=__________ ,
CH3OCH3(g)+CO2(g)的ΔH=__________ ,
二甲醚(CH3OCH3)直接作燃料电池具有启动快,效率高等优点,若电解质为酸性,该电池的负极反应为_____________________________。
(3)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的一氧化碳和水蒸气进入反应器时,会发生如下反应:CO(g)+H2O(g) ? H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
? H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.94 | 9 | 1 |
该反应的正反应方向是_________反应(填“吸热”或“放热”),若在500℃时进行,设起始时CO和H2O的起始浓度均为0.020mol/L,在该条件下,CO的平衡转化率为:________。
(4)从氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如NO、NO2、N2O4等。对反应? N2O4(g)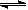 2NO2(g)? △H>0,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是___________。
2NO2(g)? △H>0,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是___________。

A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态B到状态A,可以用加热的方法
E.A、C两点的化学平衡常数:A>C
(5)NO2可用氨水吸收生成NH4NO3 。25℃时,将m mol NH4NO3溶于水,溶液显酸性,向该溶液滴加n L氨水后溶液呈中性,则滴加氨水的过程中水的电离平衡将______(填”正向”“不”或“逆向”)移动,所滴加氨水的浓度为_______mol·L-1。(NH3·H2O的电离平衡常数取Kb=2X10-5 mol·L-1)
(6)某科研单位利用原电池原理,用SO2和O2来制备硫酸,装置如右图,电极为多孔的材料能吸附气体,同时也能使气体与电解质溶液充分接触.

①溶液中H+的移动方向由______ 极到______极;(用A、B表示)
②B电极的电极反应式为__________________________。