题目内容
【题目】磷是生物体中不可缺少的元素之一它能形成多种化合物。
(1)磷元素位于周期表的______区,基态磷原子价层电子排布图_______。
(2)第三周期中第一电离能位于铝元素和磷元素之间的元素有________种。
(3)白磷(P4)分子是正四面体结构,磷原子杂化方式为______,3.1g白磷中σ键的数目为___。P4易溶于二硫化碳,难溶于水,原因是___________。
(4)磷酸与Fe3+可形成H3[FePO4)2],基态Fe3+的核外电子排布式为______,Fe、P、O电负性由大到小的顺序是____________。
(5)磷化硼是一种超硬耐磨涂层材料,下图为其晶胞结构,阿伏伽德罗常数为NA,磷化硼晶体的密度为ρg/cm3,B与P最近距离为______cm(列出计算式即可),估测该晶体的熔点_______(填“高于”或“低于”)金刚石。

【答案】 p ![]() 2 sp3 0.15NA P4和CS2是非极性分子,H2O是极性分子,根据相似相溶的原理,P4易溶于CS2,难溶于水 1s22s22p63s23p63d5 O>P>Fe
2 sp3 0.15NA P4和CS2是非极性分子,H2O是极性分子,根据相似相溶的原理,P4易溶于CS2,难溶于水 1s22s22p63s23p63d5 O>P>Fe 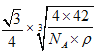 低于
低于
【解析】(1)P原子核外有15个电子,分三层排布,即有三个能层,所以电子占据的最高能层符号为M;最外层为3s2p3,则磷元素位于周期表的p区,基态磷原子价层电子排布图为![]() ,故答案为:p;
,故答案为:p;![]() ;
;
(2)同一周期元素自左而右第一电离能呈增大趋势,但P元素原子3p能级是半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故铝到磷元素的第一电离能P>S>Si>Al,所以第三周期中第一电离能位于铝元素和磷元素之间的有2种,故答案为:2;
(3)P4分子为正四面体构型,键角为60°,P4分子中每个P原子与相邻的3个P原子形成3个σ键、含有1对孤对电子,杂化轨道数目为4,则P原子采取sp3杂化;因为P4分子中每个P原子与相邻的3个P原子形成3个σ键,则平均每个P原子形成1.5个σ键,所以3.1g白磷中σ键的数目为![]() ×1.5=0.15mol,数目为0.15NA;相似相溶原理是指由于极性分子间的电性作用,使得极性分子组成的溶质易溶于极性分子组成的溶剂,难溶于非极性分子组成的溶剂;非极性分子组成的溶质易溶于非极性分子组成的溶剂,难溶于极性分子组成的溶剂,P4和CO2是非极性分子,H2O是极性分子,根据相似相溶的原理,P4易溶于CO2,难溶于水,故答案为:sp3;0.15 NA;P4和CO2是非极性分子,H2O是极性分子,根据相似相溶的原理,P4易溶于CO2,难溶于水;
×1.5=0.15mol,数目为0.15NA;相似相溶原理是指由于极性分子间的电性作用,使得极性分子组成的溶质易溶于极性分子组成的溶剂,难溶于非极性分子组成的溶剂;非极性分子组成的溶质易溶于非极性分子组成的溶剂,难溶于极性分子组成的溶剂,P4和CO2是非极性分子,H2O是极性分子,根据相似相溶的原理,P4易溶于CO2,难溶于水,故答案为:sp3;0.15 NA;P4和CO2是非极性分子,H2O是极性分子,根据相似相溶的原理,P4易溶于CO2,难溶于水;
(4)Fe原子核外有26个电子,核外电子排布为1s22s22p63s23p63d64s2,Fe原子失去4s能级2个电子、3d能级1个电子形成Fe3+,Fe3+电子排布式为1s22s22p63s23p63d5;同周期元素从左到右元素的电负性逐渐增强,则电负性:S>P,同主族元素从上到下电负性逐渐减弱,则电负性:O>S,所以电负性O>P,又Fe为金属元素,则电负性由大到小的顺序是O>P>Fe,故答案为:1s22s22p63s23p63d5;O>P>Fe;
(5)该晶胞中P原子个数=8×![]() +6×
+6×![]() =4,B原子个数为4,化学式为BP,设晶胞边长=acm,则晶胞的体积V=(acm)3,ρ=
=4,B原子个数为4,化学式为BP,设晶胞边长=acm,则晶胞的体积V=(acm)3,ρ=![]() =
=![]() gcm3,解得a=
gcm3,解得a=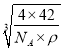 cm,根据图像,B与P最近距离为体对角线的
cm,根据图像,B与P最近距离为体对角线的![]() ,则B与P最近距离=
,则B与P最近距离=![]() ×
×![]() ×
× cm=
cm=![]() ×
×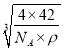 cm;P-B的键长比C-C键长大,熔点比金刚石低,故答案为:
cm;P-B的键长比C-C键长大,熔点比金刚石低,故答案为: ![]() ×
× ;低于。
;低于。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】二氯化二硫(S2Cl2)是一种重要的化工原料,常用作橡胶硫化剂,改变生橡胶受热发粘、遇冷变硬的性质。查阅资料可知S2Cl2具有下列性质:
物理性质 | 毒性 | 色态 | 挥发性 | 熔点 | 沸点 |
剧毒 | 金黄色液体 | 易挥发 | -76℃ | 138℃ | |
化学性质 | ①300 ℃以上完全分解 ②S2Cl2+Cl2 ③遇高热或与明火接触,有引起燃烧的危险 ④受热或遇水分解放热,放出腐蚀性烟气 | ||||
(1)制取少量S2Cl2
实验室可利用硫与少量氯气在110~140℃反应制得S2Cl2粗品,氯气过量则会生成SCl2。

①仪器m 的名称为__________,装置F 中试剂的作用是_________。
②装置连接顺序: A![]() ______
______![]()
![]()
![]() E
E![]() D。
D。
③实验前打开K1,通入一段时间的氮气排尽装置内空气。实验结束停止加热后,再通入一段时间的氮气,其目的是_____________。
④为了提高S2Cl2的纯度,实验的关键是控制好温度和____________。
(2)少量S2Cl2泄漏时应喷水雾减慢其挥发(或扩散),并产生酸性悬浊液,但不要对泄漏物或泄漏点直接喷水,其原因是______________。
(3)S2Cl2遇水会生成SO2、HCl两种气体,某同学设计了如下实验方案来测定该混合气体中SO2的体积分数。

①W溶液可以是_____(填标号)。
a.H2O2溶液 b.KMnO4溶液(硫酸酸化) c.氯水
②该混合气体中二氧化硫的体积分数为_________(用含V、m 的式子表示)。