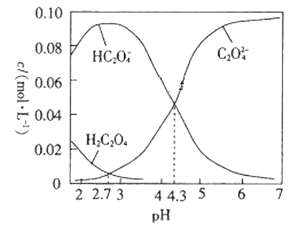
题目内容
【题目】LED灯是一种环保的光源,在相同照明效果下比传统光源节能80%以上。目前市售LED晶片材质基本以砷化镓、磷化铝镓钢(AlGaInP)、氮化铟镓( InGaN)为主,砷化镓的晶胞结构如图。回答下列问题:

(1)砷的基态原子的电子排布式是___________。
(2)磷和砷是同一族的元素,第一电离能:磷___________(填“>”“<”或“=”,下同)砷,它们形成的氢化物的沸点:PH3___________AsH3,原因是______________________。
(3)AsH3是无色、稍有大蒜味的气体。AsH3中砷原子的杂化轨道方式为___________,AsH3的空间结构为___________。
(4)砷元素的常见化合价有+3和+5,它们对应的含氧酸有H3AsO3和H3AsO4两种,其中H3AsO4的酸性比H3AsO3的酸性强,从物质结构与性质的关系来看,H3AsO4的酸性比H3AsO3的酸性强的原因是_________________________________。
(5)此晶胞中所含的砷原子的个数为___________,砷化镓的化学式为___________。
【答案】1s22s22p63s23p63d104s24p3或者[Ar]3d104s24p3 > < AsH3和PH3都属于分子晶体,两者结构相似,AsH3的相对分子质量比PH3大,范德华力强,AsH3的沸点高于PH3 sp3 三角锥 H3AsO4和H3AsO3可表示为(HO)3AsO和(HO)3As,含有一个非羟基氧原子的磷酸中的+5价的砷正电性更高,导致As-O-H中的O的电子向As偏移,氧氢键的极性变大,在水分子作用下,越容易电离出H+,酸性越强 4 GaAs
【解析】
(1)As位于第四周期VA族,基态砷原子的电子排布式为1s22s22p63s23p63d104s24p3或者[Ar]3d104s24p3;
(2)同主族从上到下,第一电离能减小,即第一电离能:磷>砷;AsH3和PH3都属于分子晶体,两者结构相似,AsH3的相对分子质量比PH3大,范德华力强,AsH3的沸点高于PH3;
(3)AsH3中心原子为As,As有3个σ键,孤电子对数为(5-3×1)/2=1,价层电子对数为4,因此As原子杂化类型为sp3;其空间构型为三角锥形;
(4)H3AsO4和H3AsO3可表示为(HO)3AsO和(HO)3As,含有一个非羟基氧原子的磷酸中的+5价的砷正电性更高,导致As-O-H中的O的电子向As偏移,氧氢键的极性变大,在水分子作用下,越容易电离出H+,酸性越强;
(5)根据晶胞的结构,As为晶胞的顶点和面心,个数为8×1/8+6×1/2=4;Ga位于晶胞内部,因此砷化镓的化学式为GaAs。