题目内容
(2013?重庆模拟)下列有关说法中,不正确的是( )
分析:A、加入氢氧化钠,抑制了亚硫酸钠的水解;
B、根据电荷守恒进行判断即可;
C、根据c(OH-)/c(H+)=1×10-8,计算出溶液中氢离子浓度,水电离的氢离子等于溶液中氢氧根离子的浓度;
D、等体积混合,溶液中也是c(Na+)>c(CN-).
B、根据电荷守恒进行判断即可;
C、根据c(OH-)/c(H+)=1×10-8,计算出溶液中氢离子浓度,水电离的氢离子等于溶液中氢氧根离子的浓度;
D、等体积混合,溶液中也是c(Na+)>c(CN-).
解答:解:A、由于氢氧化钠促进了亚硫酸钠的水解,溶液中c(SO32-)与c(Na+)均增大,故A错误;
B、根据电荷守恒,c(Na+)+c(H+)=c(CH3COO-)+c(OH-),所以c(Na+)-c(CH3COO-)=c(OH-)-c(H+)=1×10-7mol/L-1×10-8mol/L=9.9×10-7mol/L,故B错误;
C、根据c(OH-)?c(H+)=1×10-14,c(OH-)/c(H+)=1×10-8,可得c(H+)=1×10-3mol/L,溶液PH=3,溶液中的氢氧根离子是水电离,由水电离出的c(H+)=1×10-11mol/L,故C错误;
D、HCN是弱电解质,若是等体积混合,生成了NaCN溶液,溶液中c(Na+)>c(CN-),故D正确;
故选D.
B、根据电荷守恒,c(Na+)+c(H+)=c(CH3COO-)+c(OH-),所以c(Na+)-c(CH3COO-)=c(OH-)-c(H+)=1×10-7mol/L-1×10-8mol/L=9.9×10-7mol/L,故B错误;
C、根据c(OH-)?c(H+)=1×10-14,c(OH-)/c(H+)=1×10-8,可得c(H+)=1×10-3mol/L,溶液PH=3,溶液中的氢氧根离子是水电离,由水电离出的c(H+)=1×10-11mol/L,故C错误;
D、HCN是弱电解质,若是等体积混合,生成了NaCN溶液,溶液中c(Na+)>c(CN-),故D正确;
故选D.
点评:本题考查了影响盐类水解的因素,根据平衡移动原理进行判断即可,本题难度不大.

练习册系列答案
 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案
相关题目
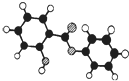 (2013?重庆模拟)萨罗(Salol)是一种消毒剂,为芳香族化合物,其分子模型如下图所示(图中球与球之间的连线代表化学键,如单键、双键等).则下列说法不正确的是( )
(2013?重庆模拟)萨罗(Salol)是一种消毒剂,为芳香族化合物,其分子模型如下图所示(图中球与球之间的连线代表化学键,如单键、双键等).则下列说法不正确的是( ) ( )
( )