题目内容
在铁和氧化铁的混合物15g中加入150mL稀H2SO4放出氢气1.68L(标准状况)。当反应停止后,铁和氧化铁均无剩余,且溶液中无Fe3+存在。为了中和过量H2SO4,并使Fe2+完全转化为Fe(OH)2沉淀,共耗用3 mol/L NaOH溶液200mL。求:
①混合物中铁和氧化铁各多少克?
②稀H2SO4的物质的量浓度为多少?
①混合物中铁和氧化铁各多少克?
②稀H2SO4的物质的量浓度为多少?
(1)混合物中铁是7g,氧化铁是8g。(2)稀H2SO4的物质的量浓度为2 mol·L-1。
(1)设铁和氧化铁的物质的量分别为x和y,则
x×56g/mol+y×160 g/mol=15g……………①
由得失电子守恒得,x×2=y×2+1.68L/22.4L/mol×2……………②
解得:x=0.25mol, y=0.05mol.即m(Fe)=0.25mol×56g/mol=7g, m(Fe2O3)=0.05mo l×160g/mol=8g
(2)在铁和氧化铁的混合物中加入稀H2SO4反应停止后,溶液中的溶质主要是H2SO4和FeSO4。
由电荷守恒知:硫酸中的硫酸根离子最后完全和钠离子结合在一起。
n(H2SO4)=1/2×3 mol/L×0.2L=0.3mol
c(H2SO4)=0.3 mol/0.15L=2 mol·L-1
x×56g/mol+y×160 g/mol=15g……………①
由得失电子守恒得,x×2=y×2+1.68L/22.4L/mol×2……………②
解得:x=0.25mol, y=0.05mol.即m(Fe)=0.25mol×56g/mol=7g, m(Fe2O3)=0.05mo l×160g/mol=8g
(2)在铁和氧化铁的混合物中加入稀H2SO4反应停止后,溶液中的溶质主要是H2SO4和FeSO4。
由电荷守恒知:硫酸中的硫酸根离子最后完全和钠离子结合在一起。
n(H2SO4)=1/2×3 mol/L×0.2L=0.3mol
c(H2SO4)=0.3 mol/0.15L=2 mol·L-1

练习册系列答案
相关题目
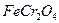 中Fe和
中Fe和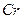 的氧化态都转化为+6氧化态,lmol
的氧化态都转化为+6氧化态,lmol 
