题目内容
今有一混合物的水溶液,可能含有以下离子中的若干种:K+、Al3+、NH4+、Mg2+、Ba2+、CO32-、SO32-、SO42-、NO2-、Cl-,现取三份100mL溶液进行如下实验:
(1)第一份加足量NaOH溶液加热后,收集到气体0.896L(标况).
(2)第二份加盐酸后,生成无色无味气体且该气体能使饱和石灰水变浑浊;继续加入加HNO3酸化后,再加过量AgNO3溶液,溶液中析出白色沉淀.
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g.根据上述实验,以下推测正确的是
- A.溶液中CO32-浓度为0.1 mol?L-1
- B.K+浓度至少为0.2mol?L-1
- C.无法确定Cl-、NO2-的存在
- D.Ba2+一定不存在,Mg2+可能大量存在
B
分析:(1)第一份加足量NaOH溶液加热后,收集到气体0.896L(标况)物质的量为0.04mol;证明原溶液中含有NH4+、亚硝酸根离子不能存在;
(2)第二份加盐酸后,生成无色无味气体且该气体能使饱和石灰水变浑浊,证明含有CO32-、一定不含有SO32-,Mg2+、Ba2+、Al3+、NO2-;继续加入加HNO3酸化后,再加过量AgNO3溶液,溶液中析出白色沉淀,不能证明含有氯离子;
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g.说明一定含有CO32-、SO42-、n(CO32-)=n(BaCO3)=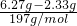 =0.02mol;n(SO42-)=n(BaSO4)=
=0.02mol;n(SO42-)=n(BaSO4)=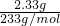 =0.01mol,
=0.01mol,
解答:(1)第一份加足量NaOH溶液加热后,收集到气体0.896L(标况)物质的量为0.04mol;证明原溶液中含有NH4+;亚硝酸根离子不能存在;
(2)第二份加盐酸后,生成无色无味气体且该气体能使饱和石灰水变浑浊,证明含有CO32-、一定不含有SO32-,Mg2+、Ba2+、Al3+;NO2-;继续加入加HNO3酸化后,再加过量AgNO3溶液,溶液中析出白色沉淀,不能证明含有氯离子;
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g.说明一定含有CO32-、SO42-、n(CO32-)=n(BaCO3)=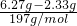 =0.02mol;n(SO42-)=n(BaSO4)=
=0.02mol;n(SO42-)=n(BaSO4)=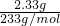 =0.01mol,
=0.01mol,
A、溶液中CO32-浓度=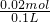 =0.2 mol?L-1;故A错误;
=0.2 mol?L-1;故A错误;
B、依据溶液中电荷守恒,若溶液中含有NH4+、CO32-、SO42-、;依据电荷计算可知银离子电荷总数=0.02mol×2+0.01mol×2=0.06mol;NH4+电荷数0.04mol;所以一定含有钾离子,且K+浓度至少为 =0.2mol/L,故B正确;
=0.2mol/L,故B正确;
C、依据分析判断,Cl-不能确定,NO2-离子一定不存在,故C错误;
D、镁离子和碳酸根了也可以形成沉淀,故D错误;
故选B.
点评:本题考查了离子检验方法和离子性质的分析判断,反应现象的判断是两种判断的依据,注意干扰离子的分析判断,题目难度中等.
分析:(1)第一份加足量NaOH溶液加热后,收集到气体0.896L(标况)物质的量为0.04mol;证明原溶液中含有NH4+、亚硝酸根离子不能存在;
(2)第二份加盐酸后,生成无色无味气体且该气体能使饱和石灰水变浑浊,证明含有CO32-、一定不含有SO32-,Mg2+、Ba2+、Al3+、NO2-;继续加入加HNO3酸化后,再加过量AgNO3溶液,溶液中析出白色沉淀,不能证明含有氯离子;
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g.说明一定含有CO32-、SO42-、n(CO32-)=n(BaCO3)=
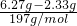 =0.02mol;n(SO42-)=n(BaSO4)=
=0.02mol;n(SO42-)=n(BaSO4)=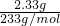 =0.01mol,
=0.01mol,解答:(1)第一份加足量NaOH溶液加热后,收集到气体0.896L(标况)物质的量为0.04mol;证明原溶液中含有NH4+;亚硝酸根离子不能存在;
(2)第二份加盐酸后,生成无色无味气体且该气体能使饱和石灰水变浑浊,证明含有CO32-、一定不含有SO32-,Mg2+、Ba2+、Al3+;NO2-;继续加入加HNO3酸化后,再加过量AgNO3溶液,溶液中析出白色沉淀,不能证明含有氯离子;
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g.说明一定含有CO32-、SO42-、n(CO32-)=n(BaCO3)=
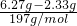 =0.02mol;n(SO42-)=n(BaSO4)=
=0.02mol;n(SO42-)=n(BaSO4)=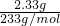 =0.01mol,
=0.01mol,A、溶液中CO32-浓度=
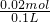 =0.2 mol?L-1;故A错误;
=0.2 mol?L-1;故A错误;B、依据溶液中电荷守恒,若溶液中含有NH4+、CO32-、SO42-、;依据电荷计算可知银离子电荷总数=0.02mol×2+0.01mol×2=0.06mol;NH4+电荷数0.04mol;所以一定含有钾离子,且K+浓度至少为
 =0.2mol/L,故B正确;
=0.2mol/L,故B正确;C、依据分析判断,Cl-不能确定,NO2-离子一定不存在,故C错误;
D、镁离子和碳酸根了也可以形成沉淀,故D错误;
故选B.
点评:本题考查了离子检验方法和离子性质的分析判断,反应现象的判断是两种判断的依据,注意干扰离子的分析判断,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
今有一混合物的水溶液,含有以下离子中的若干种:Na+、NH+4、Cl-、Ba2+、HCO3-、SO42-,现取三份100mL该溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液,加热,收集到标准状况下的气体448mL
(3)第三份加足量Ba(OH)2溶液,得沉淀4.30g,再用足量盐酸洗涤、干燥后,沉淀质量为2.33g.根据上述实验,下列推测正确的是( )
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液,加热,收集到标准状况下的气体448mL
(3)第三份加足量Ba(OH)2溶液,得沉淀4.30g,再用足量盐酸洗涤、干燥后,沉淀质量为2.33g.根据上述实验,下列推测正确的是( )
| A、Na+一定存在 | B、100mL该溶液中含0.1mol HCO-3 | C、Ba2+一定存在 | D、Cl-一定不存在 |
今有一混合物的水溶液,只可能含有以下离子中的若干种:Na+、NH4+、Ba2+、Cl-、CO32-、SO42-.现取两份200mL溶液进行如下实验,根据实验以下推测正确的是( )
①第一份加足量NaOH溶液,加热,收集到气体1.36g;
②第二份加足量BaCl2溶液后,得干燥沉淀12.54g,经足量盐酸洗涤、干燥后,沉淀质量为4.66g.
①第一份加足量NaOH溶液,加热,收集到气体1.36g;
②第二份加足量BaCl2溶液后,得干燥沉淀12.54g,经足量盐酸洗涤、干燥后,沉淀质量为4.66g.
| A、一定不存在Ba2+,NH4+可能存在 | B、CO32-一定不存在 | C、Na+一定存在 | D、一定不存在Cl- |