题目内容
18.下列各装置能组成原电池的是( )| A. |  乙醇 | B. | 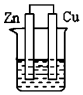 稀H2SO4 | C. |  稀H2SO4 | D. |  稀H2SO4 |
分析 根据原电池的构成条件分析,原电池的构成条件是:①有两个活泼性不同的电极,②将电极插入电解质溶液中,③两电极间构成闭合回路,④能自发的进行氧化还原反应,以此解答该题.
解答 解:A.乙醇不导电,不能形成原电池,故A错误;
B.两电极材料不同,锌较活泼能和稀硫酸自发的进行氧化还原反应,且构成了闭合回路,所以能构成原电池,故B正确;
C.没有形成闭合回路,不能形成原电池,故C错误;
D.铜与稀硫酸不能发生氧化还原反应,电极相同不能形成电势差,不能形成原电池,故D错误.
故选B.
点评 本题考查了原电池原理,为高频考点,侧重于学生的分析能力的考查,明确原电池的构成条件是解本题关键,根据原电池的构成条件来分析解答即可,题目难度不大.

练习册系列答案
相关题目
7.反应A+3B=2C+2D在不同条件下反应速率如下,其中最快的是( )
| A. | v(A)=0.15 mol/(L•min) | B. | v(B)=0.6 mol/(L•min) | ||
| C. | v(C)=0.4 mol/(L•min) | D. | v(D)=0.8 mol/(L•min) |
9.下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 强酸性溶液中:K+、Cu2+、NO3- | |
| B. | 强碱性溶液中:Na+、NH4+、Cl- | |
| C. | 含1 mol•L-1 NH3•H2O的溶液中:K+、Al3+、SO42- | |
| D. | 含1 mol•L-1 Fe3+的溶液中:H+、Na+、SCN- |
6.金刚烷是一种重要的化工原料,工业上可通过下列途径制备.下列说法中正确的是( )


| A. | 环戊二烯中的所有原子共平面 | |
| B. | 二聚环戊二烯的分子式为C10H10 | |
| C. | 四氢二聚环戊二烯与金刚烷互为同分异构体 | |
| D. | 金刚烷的一氯代物有6种 |
13.下列实验操作不能达到相应实验目的是( )
| 选项 | 实验目的 | 实验操作 |
| A | 比较水与乙醇中氢的活泼性 | 分别将少量钠投入到乙醇和水中,观察现象 |
| B | 检验淀粉酸性水解液中含葡萄糖 | 向水解液中直接加入少量Cu(OH)2悬浊液,加热 |
| C | 提纯含有少量乙酸的乙酸乙酯 | 试样中加入足量饱和碳酸钠溶液,振荡后静置分液,并除去有机层中的水 |
| D | 验证温度对化学反应速率的影响 | 在两支试管中各加入5mL12%H2O2 溶液,将其中一支用水浴加热,观察并比较实验现象 |
| A. | A | B. | B | C. | C | D. | D |
3.下列实验中,仪器的下端必须插入液面下的是( )
| A. | 制备氯气装置中的分液漏斗 | B. | 制备Fe(OH)2操作中的胶头滴管 | ||
| C. | 分馏石油时的温度计 | D. | 将氯化氢气体溶于水时的导管 |
2.可以准确判断有机物分子中含有哪些官能团的分析方法是( )
| A. | 核磁共振氢谱 | B. | 质谱 | C. | 紫外光谱 | D. | 红外光谱 |
20.与100mL0.1mol/L AlCl3溶液中Cl-的物质的量浓度相等的是( )
| A. | 50mL0.1mol/L NaCl溶液 | B. | 50mL0.15mol/L MgCl2溶液 | ||
| C. | 10mL1.0mol/L FeCl3溶液 | D. | 100mL0.3mol/L KClO3溶液 |
 和
和 都能反应的是b.(填字母)
都能反应的是b.(填字母)