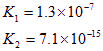题目内容
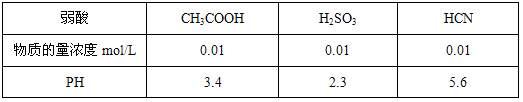
25°C时,几种弱酸溶液的PH如下表所示:
| 弱酸 | CH3COOH | H2SO3 | HCN |
| 物质的量浓度mol/L | 0.01 | 0.01 | 0.01 |
| PH | 3.4 | 2.3 | 5.6 |
下列有关说法正确的是
- A.相同PH的CH3COOH与HCN溶液中水电离的氢离子浓度CH3COOH溶液中的大
- B.物质的量浓度相同的CH3COONa与NaCN溶液中,各离子浓度之和两者相等
- C.25°C时,HCN溶液的电离平衡常数(Ka)与NaCN溶液的水解平衡常数(K)存在如下关系:Ka ·K = Kw
- D.0.01mol/L的Na2SO3溶液与0.01mol/L的CH3COONa溶液相比,一定是后者的碱性强
C
根据酸的酸碱性可知,醋酸的酸性强于HCN。但在pH相等的条件小,对水的抑制程度是相同的,A不正确。物质的量浓度相同的CH3COONa与NaCN溶液中,后者的水解程度大,碱性强,氢离子浓度小。由于钠离子的浓度都是相同的,因此根据电荷守恒可知,前者中离子浓度之和大于后者,B不正确。根据NaCN的水解方程式和电离方程式可知
CN-+H2O HCN+OH-、HCN
HCN+OH-、HCN![]() CN-+H+,Ka=
CN-+H+,Ka= 、
、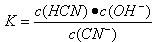 ,选项C正确。在其他条件相同的情况下,选项D才是正确,例如温度不同,则不能比较。答案选C。
,选项C正确。在其他条件相同的情况下,选项D才是正确,例如温度不同,则不能比较。答案选C。
根据酸的酸碱性可知,醋酸的酸性强于HCN。但在pH相等的条件小,对水的抑制程度是相同的,A不正确。物质的量浓度相同的CH3COONa与NaCN溶液中,后者的水解程度大,碱性强,氢离子浓度小。由于钠离子的浓度都是相同的,因此根据电荷守恒可知,前者中离子浓度之和大于后者,B不正确。根据NaCN的水解方程式和电离方程式可知
CN-+H2O
 HCN+OH-、HCN
HCN+OH-、HCN 、
、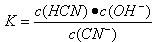 ,选项C正确。在其他条件相同的情况下,选项D才是正确,例如温度不同,则不能比较。答案选C。
,选项C正确。在其他条件相同的情况下,选项D才是正确,例如温度不同,则不能比较。答案选C。 
练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
25°C时,几种弱酸溶液的PH如下表所示:
|
弱酸 |
CH3COOH |
H2SO3 |
HCN |
|
物质的量浓度mol/L |
0.01 |
0.01 |
0.01 |
|
PH |
3.4 |
2.3 |
5.6 |
下列有关说法正确的是
A.相同PH的CH3COOH与HCN溶液中水电离的氢离子浓度CH3COOH溶液中的大
B.物质的量浓度相同的CH3COONa与NaCN溶液中,各离子浓度之和两者相等。
C.25°C时,HCN溶液的电离平衡常数(Ka)与NaCN溶液的水解平衡常数(K)存在
如下关系:Ka ·K = Kw
D.0.01mol/L的Na2SO3溶液与0.01mol/L的CH3COONa溶液相比,一定是后者的碱性强
25°C时,几种弱酸的电离常数如下
| 弱酸化学式 | CH3COOH | HCN | H2S |
| 电离常数(25°C) | 1.8 |
|
|
25°时,下列说法正确的是 ( )
A.等物质的量浓度的各溶液pH关系为:pH(CH3COONa)>pH(Na2S)>pH(NaCN)
B.a mol/L HCN溶液与b mol/L NaOH溶液等体积混合,所得溶液中c(Na+)>c(CN-),则a一定大于b
C.某浓度HCN的水溶液pH=d,则其中c(OH-)=10-dmol/L
D.NaHS和Na2S混合溶液中,一定存在c(Na+)+c(H+)===c(OH-)+c(HS-)+2c
(S2-)
25°C时,几种弱酸溶液的PH如下表所示:
| 弱酸 | CH3COOH | H2SO3 | HCN |
| 物质的量浓度mol/L | 0.01 | 0.01 | 0.01 |
| PH | 3.4 | 2.3 | 5.6 |
A.相同PH的CH3COOH与HCN溶液中水电离的氢离子浓度CH3COOH溶液中的大
B.物质的量浓度相同的CH3COONa与NaCN溶液中,各离子浓度之和两者相等。
C.25°C时,HCN溶液的电离平衡常数(Ka)与NaCN溶液的水解平衡常数(K)存在
如下关系:Ka ·K = Kw
D.0.01mol/L的Na2SO3溶液与0.01mol/L的CH3COONa溶液相比,一定是后者的碱性强