题目内容
根据下图仪器和装置填空: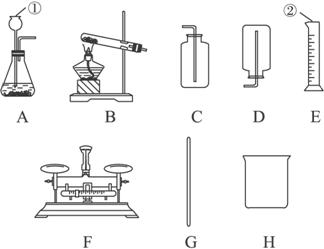
(1)写出图中①②仪器的名称:①____________,②____________。
(2)为完成下列实验,请选择所需仪器或装置,将其编号填在横线上。
Ⅰ.实验室制取并收集氧气________________________;
Ⅱ.实验室制取并收集氢气________________________。
(1)①长颈漏斗 ②量筒 (2)Ⅰ?B、C Ⅱ?A、D
解析:主要考查仪器、装置的名称及作用。气体发生装置的选择,一般根据反应物的状态、反应条件、反应原理等来选择。若是固体和液体反应不需加热,则选择A装置;若是固体(或固体+固体)反应需加热,则选择B装置。气体收集装置的选择原则是:若气体的密度比空气密度大,则选择C装置;反之,选择D装置。根据以上原则可知实验室制取并收集H2应选择的装置是A、D;制取并收集O2的装置应选择B、C。

练习册系列答案
相关题目