��Ŀ����
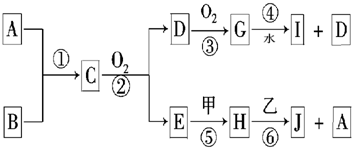
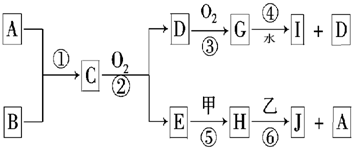
��֪��A��BΪ�����ڷǽ��������Ҿ�Ϊ���壻�ס���Ϊ�����ڽ������ʣ�����I��Ũ��Һ�з����ۻ���C��H��J����Һ���ʼ��ԣ������ʼ��ת����ϵ���£�����������δ��������δע����Ӧ��������
��1��д��A�ĵ���ʽ______��C���ӵĿռ乹�ͣ�______��
��2��д����Ӧ�ڵĻ�ѧ����ʽ______��
��3����Ӧ�ܵĻ�ѧ����ʽΪ______��
��4����Ӧ�ݵĻ�ѧ����ʽ��______��
��5����Ӧ�����ӷ���ʽ��______��
�⣺A��BΪ�����ڷǽ��������Ҿ�Ϊ���壬C�ܷ���������������G��ˮ��Ӧ����CΪNH3��DΪNO��GΪNO2��IΪ����ɷ�Ӧ��Ϊ������������Ӧ����NO��ˮ����EΪH2O���ס���Ϊ�����ڽ������ʣ����ΪNa��HΪNaOH����ΪAl��JΪNaAlO2��AΪH2���ɷ�Ӧ�ٿ�֪��BΪN2��
��1��AΪH2�������ʽΪH��H��CΪNH3���ռ乹��Ϊ�����Σ��ʴ�Ϊ��H��H�������Σ�
��2����Ӧ��Ϊ4NH3+5O2 4NO+6H2O���ʴ�Ϊ��4NH3+5O2
4NO+6H2O���ʴ�Ϊ��4NH3+5O2 4NO+6H2O��
4NO+6H2O��
��3����Ӧ��Ϊ3NO2+H2O�T2HNO3+NO���ʴ�Ϊ��3NO2+H2O�T2HNO3+NO��
��4����Ӧ��Ϊ2Na+2H2O�T2NaOH+H2�����ʴ�Ϊ��2Na+2H2O�T2NaOH+H2����
��5����Ӧ�����ӷ���ʽΪ2Al+2H2O+2OH-�T2AlO2-+3H2�����ʴ�Ϊ��2Al+2H2O+2OH-�T2AlO2-+3H2����
������A��BΪ�����ڷǽ��������Ҿ�Ϊ���壬C�ܷ���������������G��ˮ��Ӧ����CΪNH3��DΪNO��GΪNO2��IΪ����ɷ�Ӧ��Ϊ������������Ӧ����NO��ˮ����EΪH2O���ס���Ϊ�����ڽ������ʣ����ΪNa��HΪNaOH����ΪAl��JΪNaAlO2��AΪH2���ɷ�Ӧ�ٿ�֪��BΪN2��Ȼ�������ʵ����ʼ���ѧ���������
���������⿼��������ƶϣ�C�ܷ���������������G��ˮ��Ӧ�Ƴ�CΪ�����ǽ���ͻ�ƿڣ�����ת����ϵ�����ʵ������ƶϸ������ǽ����Ĺؼ�����Ŀ�Ѷ��еȣ�
��1��AΪH2�������ʽΪH��H��CΪNH3���ռ乹��Ϊ�����Σ��ʴ�Ϊ��H��H�������Σ�
��2����Ӧ��Ϊ4NH3+5O2
 4NO+6H2O���ʴ�Ϊ��4NH3+5O2
4NO+6H2O���ʴ�Ϊ��4NH3+5O2 4NO+6H2O��
4NO+6H2O����3����Ӧ��Ϊ3NO2+H2O�T2HNO3+NO���ʴ�Ϊ��3NO2+H2O�T2HNO3+NO��
��4����Ӧ��Ϊ2Na+2H2O�T2NaOH+H2�����ʴ�Ϊ��2Na+2H2O�T2NaOH+H2����
��5����Ӧ�����ӷ���ʽΪ2Al+2H2O+2OH-�T2AlO2-+3H2�����ʴ�Ϊ��2Al+2H2O+2OH-�T2AlO2-+3H2����
������A��BΪ�����ڷǽ��������Ҿ�Ϊ���壬C�ܷ���������������G��ˮ��Ӧ����CΪNH3��DΪNO��GΪNO2��IΪ����ɷ�Ӧ��Ϊ������������Ӧ����NO��ˮ����EΪH2O���ס���Ϊ�����ڽ������ʣ����ΪNa��HΪNaOH����ΪAl��JΪNaAlO2��AΪH2���ɷ�Ӧ�ٿ�֪��BΪN2��Ȼ�������ʵ����ʼ���ѧ���������
���������⿼��������ƶϣ�C�ܷ���������������G��ˮ��Ӧ�Ƴ�CΪ�����ǽ���ͻ�ƿڣ�����ת����ϵ�����ʵ������ƶϸ������ǽ����Ĺؼ�����Ŀ�Ѷ��еȣ�

��ϰ��ϵ�д�
 �߲������Ӧ��һ��ͨϵ�д�
�߲������Ӧ��һ��ͨϵ�д�
�����Ŀ
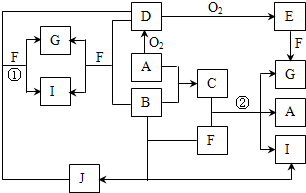 �ɶ�����Ԫ����ɵ�10������A��J֮������ͼ��ϵ����֪��A��BΪͬ��������Ԫ�صĵ��ʣ������Ϊ�����ͨ�������AΪ���壬B��DΪ������B�ʻ���ɫ��FΪҺ�壬A��G��Ũ��Һ����ʱ��Ӧ����D��F��J�ڹ���ʱ��I���ɣ�
�ɶ�����Ԫ����ɵ�10������A��J֮������ͼ��ϵ����֪��A��BΪͬ��������Ԫ�صĵ��ʣ������Ϊ�����ͨ�������AΪ���壬B��DΪ������B�ʻ���ɫ��FΪҺ�壬A��G��Ũ��Һ����ʱ��Ӧ����D��F��J�ڹ���ʱ��I���ɣ�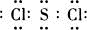
 MnCl2+Cl2��+2H2O
MnCl2+Cl2��+2H2O
