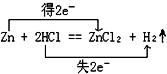
题目内容
在实验室里,用50mL的浓盐酸与一定量的MnO2反应,来制取氯气.
(1)用“双线桥法”标出电子转移情况MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
(2)若生成2.8L标准状况时的氯气,请计算:
①理论上需要多少克MnO2参加反应?
②被氧化的HCl的物质的量为多少?
(1)用“双线桥法”标出电子转移情况MnO2+4HCl(浓)
| ||
(2)若生成2.8L标准状况时的氯气,请计算:
①理论上需要多少克MnO2参加反应?
②被氧化的HCl的物质的量为多少?
解(1)反应中Mn元素化合价降低,化合价由+4价降低到+2价,Cl元素化合价升高,由-1价升高到0价,氧化还原反应中得失电子数目相等,表现为化合价升降的总数相等,可表示为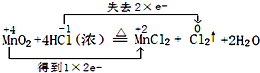 ,
,
答: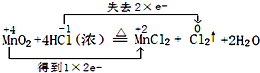 ;
;
(2)n(Cl2)=
=0.125mol,
①MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
87g1mol
m 0.125mol
m=10.88g,
答:理论上需要10.88gMnO2参加反应;
②MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O 被氧化HCl
1mol2mol
0.125moln
n=0.25mol,
答:被氧化的HCl的物质的量为0.25mol.
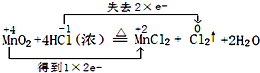 ,
,答:
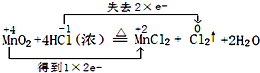 ;
;(2)n(Cl2)=
| 2.8L |
| 22.4L/mol |
①MnO2+4HCl(浓)
| ||
87g1mol
m 0.125mol
m=10.88g,
答:理论上需要10.88gMnO2参加反应;
②MnO2+4HCl(浓)
| ||
1mol2mol
0.125moln
n=0.25mol,
答:被氧化的HCl的物质的量为0.25mol.

练习册系列答案
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案
相关题目