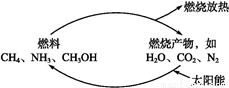
题目内容
下列叙述正确的是
A. 氨水能导电,所以氨水是电解质
B. 氯化氢溶于水后能导电,但液态氯化氢不能导电
C. 溶于水后能电离出H+的化合物都是酸
D. 导电性强的物质一定是强电解质
 名校课堂系列答案
名校课堂系列答案[实验化学]
实验室以苯甲酸和乙醇为原料制备甲酸乙酯(实验装置如图所示,相关物质的沸点如下表)。其实验步骤如下:
物质 | 苯甲酸 | 乙醇 | 环己烷 | 浓硫酸 | 苯甲酸乙酯 |
沸点/℃ | 249 | 78.3 | 80.7 | 338 | 212.6 |
步骤1:将三颈瓶中的苯甲酸、乙醇、浓硫酸和环己烷按一定配比充分混合后,升温至60 ℃。
步骤2:将反应混合物倒入分液漏斗中,静置、分液。
步骤3:向上层液体中加入乙醚,再向混合液中加入饱和碳酸钠溶液,分离出乙醚层。
步骤4:向乙醚层中加入固体氯化钙后进行蒸馏,收集相应馏分。
(1)反应容器中制取苯甲酸乙酯的化学方程式为_____;实验装置中冷凝管的主要作用是_________。
(2)向反应体系中加入环己烷,可以提高产物效率的原因是_______________。
(3)步骤4中加入固体氯化钙的作用是___________。
(4)向反应体系中加入苯也可以制取苯甲酸乙酯,用环己烷代替苯的优点是____________。
(5)步骤3中加入乙醚和饱和碳酸钠溶液的作用是__________。
一定条件下,在三个容积均为2L的恒容密闭容器中发生反应:H2(g)+CO2(g)  HCOOH(g)。下列说法正确的是
HCOOH(g)。下列说法正确的是
容器编号 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/mol | |
H2 | CO2 | HCOOH | |||
Ⅰ | 150 | 0.4 | 0.4 | 0.2 | 2 |
Ⅱ | 150 | 0.8 | 0.8 | t1 | |
Ⅲ | 0.4 | 0.4 | 0.16 | t2 | |
A. 反应达到平衡时,容器Ⅰ中的平均反应速率为v(H2)=0.1mol/(L·min)
B. 反应达到平衡时,容器Ⅱ所需时间t2<2min
C. 若只改变一个反应条件,容器Ⅲ可能是加入了合适的催化剂
D. 起始时,向容器Ⅱ中充入0.45mol H2、0.20mol CO2 和0.18molHCOOH,则反应向正反应方向进行