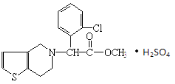
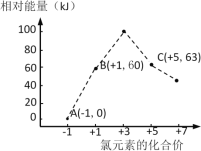��Ŀ����
����Ŀ���о�����Ԫ���й����ʵĽṹ�����ʺ�ת������Ҫ���塣
����֪P4��P4O6�Ľṹ��������ѧ���������£�
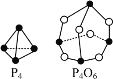
��ѧ�� | P��P | P��O | O��O |
���ܣ�kJ��mol��1�� | a | b | c |
��P4ȼ�յ��Ȼ�ѧ��Ӧ����ʽ��P4(s)��3O2(g)��P4O6(s) ��H��_______kJ��mol��1��
��������(H3PO3) ��һ�־�ϸ������Ʒ����֪25��ʱ�������ᣨH3PO3����Ka1=5��10��2��Ka2=2.5��10��7��0.1 mol��L��1 NaH2PO3��Һ��H3PO3��H2PO![]() ��HPO
��HPO![]() ��Ũ���ɴ�С��˳����_______��
��Ũ���ɴ�С��˳����_______��
�Ǵƻ�(As2S3)���ۻ�(As4S4)���ڶ��������滭���ϣ��ֶ����п�������Ч��������ҩ��һ�������£��ƻƺ��ۻƵ�ת����ϵ��ͼ1��ʾ��
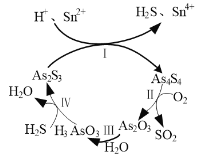
ͼ1 ͼ2
�ٷ�Ӧ������ӷ���ʽΪ______��
�ڷ�Ӧ���У���1 mol As4S4�μӷ�Ӧ��ת�Ƶ��ӵ����ʵ���Ϊ______��
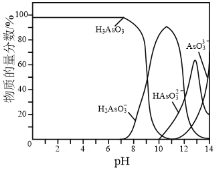
�ȳ����£���NaOH��Һ�ζ�H3AsO3��Һ����As�������ʵ���������pH�ı仯��ͼ2��ʾ��
�ٽ�NaOH��Һ�μӵ����з�̪��H3AsO3��Һ�У�����Һ����ɫ��Ϊ��ɫʱ��Ҫ��Ӧ�����ӷ���ʽΪ______��
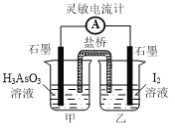
��һ��������H3AsO3�ɷ������·�Ӧ�� H3AsO3��I2��H2O![]() H3AsO4��2H����2I�����ø÷�Ӧ�������ͼ��ʾ��ԭ��ء������ĵ缫��ӦʽΪ_______������Ӧ�ﵽƽ�������м�
H3AsO4��2H����2I�����ø÷�Ӧ�������ͼ��ʾ��ԭ��ء������ĵ缫��ӦʽΪ_______������Ӧ�ﵽƽ�������м�
��NaOH��������������_______��������׳����� �����ҳ��������������ƶ���
���𰸡�(6a��3c��12b) c(H2PO![]() )��c(HPO
)��c(HPO![]() )��c(H3PO3) 2As2S3��2Sn2����4H����As4S4��2Sn4����2H2S�� 28 mol H3AsO3��OH����H2AsO
)��c(H3PO3) 2As2S3��2Sn2����4H����As4S4��2Sn4����2H2S�� 28 mol H3AsO3��OH����H2AsO![]() ��H2O H3AsO3��2e����H2O��H3AsO4��2H+ ��׳�
��H2O H3AsO3��2e����H2O��H3AsO4��2H+ ��׳�
��������
��1����P4�ṹ֪��Ӧ�Ͽ�6molP��P�����Ͽ�3molO��O���γ�12molP��O���ʦ�H����Ӧ��ļ����ܺ�-������ļ����ܺ�= (6a��3c��12b) kJ��mol-1��
��2��H2PO![]() ˮ�ⳣ��Kh=
ˮ�ⳣ��Kh=![]() =
=![]() =2��10��13��Ka2> Kh����H2PO
=2��10��13��Ka2> Kh����H2PO![]() ����̶ȴ���ˮ��̶ȣ��� c(HPO
����̶ȴ���ˮ��̶ȣ��� c(HPO![]() )��c(H3PO3)������������Ũ���ɴ�С��˳��Ϊc(H2PO
)��c(H3PO3)������������Ũ���ɴ�С��˳��Ϊc(H2PO![]() )��c(HPO
)��c(HPO![]() )��c(H3PO3)��
)��c(H3PO3)��
��3������ͼ�жϷ�Ӧ���з�Ӧ��ΪAs2S3��Sn2����H����������ΪAs4S4��Sn4����H2S����Ӧ��As�Ļ��ϼ���+3�۽���+2�ۣ�Sn�Ļ��ϼ���+2������+4�ۣ����ݵ�ʧ�����غ㡢ԭ���غ�͵���غ㣬��Ӧ�����ӷ���ʽΪ 2As2S3��2Sn2����4H����As4S4��2Sn4����2H2S����
����ͼ�� ![]() ��O2��Ӧ����
��O2��Ӧ����![]() ��
��![]() ��1���� As4S4������̬1��4+6��4=28����1 mol As4S4�μӷ�Ӧ��ת�Ƶ���28mol��
��1���� As4S4������̬1��4+6��4=28����1 mol As4S4�μӷ�Ӧ��ת�Ƶ���28mol��
��4���ٷ�̪��Һ��ɫ��pH��ΧΪ8.2~10������ɫ��Ϊdz��ɫ����ͼ֪H3AsO3��OH����H2AsO![]() ��H2O��
��H2O��
������ʧȥ���ӷ���������Ӧ�������ĵ缫��Ӧʽ��H3AsO3��2e����H2O��H3AsO4��2H+������м���NaOH��������H+ƽ�������ƶ����׳����������������������׳��ƶ���

����Ŀ��KMnO4��ʵ���ҡ������ѧ�о�����ҵ�������й㷺��Ӧ�á���֪һ���Ʊ�KMnO4��ʵ�����̡�ԭ��������������£�

ԭ������ӦI��3MnO2+KClO3+6KOH![]() 3K2MnO4+KCl+3H2O
3K2MnO4+KCl+3H2O
��Ӧ��3K2MnO4+2CO2=2KMnO4+MnO2��+2K2CO3
(ī��ɫ) (�Ϻ�ɫ)
��֪��25�����ʵ��ܽ��g/100gˮ
K2CO3 | KHCO3 | KMnO4 |
111 | 33.7 | 6.34 |
(1)����ڵĸ���Ӧ�����������������ɣ��÷�Ӧ�Ļ�ѧ����ʽΪ___________��
(2)�������CO2______(��ܡ�������)������ԭ����_____________��
(3)�����п�ѭ�����õ�������Ҫ��_________(д��ѧʽ)��
(4)���Ա������к������ʵ�ѭ�����ã�������0.3mol MnO2���õ���ƷKMnO4������Ϊ________g��ijͬѧ��ʵ���еõ������Ʒ��������������ֵ���ų��������أ��Ӳ���߷��������ܵ�ԭ����_______________��
(5)�����Ƶζ�������������ش��Ȳ������£�
��.��ȡ1.5800g������ز�Ʒ�����100mL��Һ
��.ȷ��ȡ����0.5360g�Ѻ�ɵ�Na2C2O4������������ͬ�Ľྻ��ƿ�У��ֱ������������ˮʹ���ܽ⣬�ټ������������ữ��
��.��ƿ����Һ���ȵ�75��80�棬������I�����Ƶĸ��������Һ�ζ����յ㡣��¼ʵ���������
ʵ����� | V1(�ζ�ǰ����/mL) | V2(�ζ������/mL) | (V2 -V1)/mL |
1 | 2.65 | 22.67 | 20.02 |
2 | 2.60 | 23.02 | 20.42 |
3 | 2.60 | 22.58 | 19.98 |
��֪��2MnO4��+ 5C2O42��+16H+ =2Mn/span>2++ 10CO2��+ 8H2O����KMnO4�Ĵ���Ϊ__________(������λ��Ч����)�����ζ����ӵζ��ܶ���������KMnO4�Ĵ��Ƚ�___(�ƫ�ߡ���ƫ�͡�����Ӱ�족)��