题目内容
(6分)根据烷、烯、炔烃燃烧的反应方程式,有人总结出以下规律:
对于烷烃有:n(烷烃)=n(H2O)−n(CO2),对于烯烃有n(H2O)−n(CO2)=0,对于炔烃有
n(炔烃)=n(CO2)−n(H2O)。请回答下列问题:
(1)某混合气体由C2H6和C3H4组成。将1.0L混合气在氧气中充分燃烧,产生的CO2体积比水蒸气多0.2L(相同状况下测定),通过计算确定C2H6的体积。(请写出计算过程)
(2)某混合气由烯烃和烷烃或烯烃和炔烃组成。组成中可能是两种气体,也可能是多种气体。将1.0L混合气在氧气中充分燃烧,产生3.0LCO2和2.4L水蒸气(相同状况下测定)。试判断混合气是由烯烃和 两类烃组成,其体积比为 。
⑴设混合气体中C2H6和C3H4的体积分别为aL和bL,由两个反应式可得出下列关系:
C2H6+3.5O2→2CO2+3H2O; C3H4+4O2→3CO2+2H2O;
a 2a 3a b 3b 2b
a + b = 1.0 L a=0.4L
(2a+3b)-(3a+2b)=0.2L b=0.6L
则混合气体中C2H6的体积为0.4L。(3分,若无计算过程,只有答案,则给1分)
(2)炔烃(1分) 2:3 (2分)
【解析】 考查根据方程式进行的有关计算。
⑴设混合气体中C2H6和C3H4的体积分别为aL和bL,由两个反应式可得出下列关系:
C2H6+3.5O2→2CO2+3H2O; C3H4+4O2→3CO2+2H2O;
a 2a 3a b 3b 2b
a + b = 1.0 L a=0.4L
(2a+3b)-(3a+2b)=0.2L b=0.6L
则混合气体中C2H6的体积为0.4L。
(2)1.0L混合气在氧气中充分燃烧,产生3.0LCO2和2.4L水蒸气(相同状况下测定),所以混合气的平均分子组成是C3H4.8。即氢原子和碳原子的个数之比是1.6.由于烷烃、烯烃和炔烃中氢原子和碳原子的个数之比(2+n/2)、2和(2-n/2),所以混合气一定是烯烃和炔烃组成的。分别是丙烯和丙炔,其体积之比是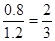 。
。

 阅读快车系列答案
阅读快车系列答案