题目内容
常温下的两种溶液:①pH=9的NaOH溶液,②pH=9的CH3COONa溶液。对这两种溶液的判断,正确的是
| A.两溶液中水的电离程度相同 |
| B.c(Na+):①>② |
| C.两溶液分别用水稀释10倍后,pH①=pH②<9 |
| D.将①和②等体积混合后的溶液:c(Na+)=c(CH3COO-)+c(OH-)-c(H+) |
D
试题分析:A、氢氧化钠抑制水的电离,而醋酸钠水解促进水的电离,两溶液中水的电离程度②>①,A错误; B、①中钠离子的浓度近似等于氢氧根离子的浓度,即10-5mol/L,而醋酸钠溶液中醋酸根离子水解比较微弱,所以钠离子的浓度远远大于水解生成的氢氧根离子的浓度,故c(Na+):①<②;C、稀释时醋酸钠的水解平衡向右移动,故pH①<pH②但都大于9,故C错误;D项中将氢离子移向左边,再根据溶液中的电荷守恒可判断D正确;故选D。

练习册系列答案
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案
相关题目


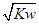 mol·L-1
mol·L-1