题目内容
17.已知反应A2(g)+2B2(g)═2AB2(g)的能量变化如图所示,下列叙述中不正确的是( )
| A. | 该反应为放热反应 | |
| B. | 该反应过程既有物质变化,又有能量变化 | |
| C. | 该反应生成物的总能量高于反应物的总能量 | |
| D. | 该反应每生成2molAB2吸收的热量为(a-b)kJ |
分析 A、依据图象反应物总能量小于生成物总能量来分析;
B、化学反应过程既有物质变化,又有能量变化;
C、由图可知,生成物的总能量高于反应物的总能量;
D、依据图象分析判断1molA2和1molB2反应生成2molAB2,能量变化为(a-b).
解答 解:A、依据图象反应物总能量小于生成物总能量,所以为吸热反应,故A错误;
B、化学反应过程既有物质变化,又有能量变化,故B正确;
C、由图可知,生成物的总能量高于反应物的总能量,故C正确;
D、依据图象分析判断1molA2和1molB2反应生成2molAB2,吸收(a-b)kJ热量,故D正确;
故选A.
点评 本题考查了化学反应的能量变化,图象分析判断,注意反应热△H=反应物能量总和-生成物能量总和,题目较简单.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
7.下列为几种分子的球棍模型,所有原子处于同一平面的是 ( )
| A. |  甲烷 | B. |  乙烷 | C. |  丙烷 | D. |  苯 |
8.下列是一些制取物质的设计或设想,其中违背科学原理的是( )
| A. | 用玉米、植物秸杆等作原料制造乙醇,用作汽车的燃料 | |
| B. | 用动物的骨或皮作原料制造中药,用作滋补品 | |
| C. | 用淀粉作原料提取淀粉酶,用作催化剂 | |
| D. | 用植物油或动物脂肪作原料制造人造金刚石 |
5.常温常压时,下列叙述不正确的是( )
| A. | pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(Na2CO3)<c(CH3COONa) | |
| B. | pH=5的①NH4Cl溶液②CH3COOH溶液③盐酸溶液中由水电离出的c(H+):①>②>③ | |
| C. | 等体积pH=12的NaOH溶液和pH=2的CH3COOH溶液混合,混合后溶液pH<7 | |
| D. | 0.1mol•L-1的CH3COOH溶液pH=a,0.01mol•L-1的CH3COOH溶液pH=b,则b<a+1 |
12.化学科学需要借助化学专用语言来描述,下列有关化学用语正确的是( )
| A. | 过氧化钠的电子式: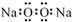 | |
| B. | “玉兔”号月球车上使用的质子数94,中子数144的钚原子:${\;}_{94}^{144}$Pu | |
| C. | CH4的球棍模型: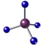 | |
| D. | Na的原子结构示意图: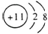 |
9.已知:2NO2 ?N2O4△H<0,CaO溶于水放热,NH4Cl晶体溶于水吸热.在3个体积相等的圆底烧瓶中充满等量的NO2气体,并分别放置在加有下列物质的烧杯(烧杯内有水)中:(1)中加入CaO,(2)中加入NH4Cl晶体,(3)中不加任何其它物质,如图所示.下列叙述正确的是( )


| A. | (1)中红综色变深,(2)中红棕色变浅 | B. | (1)中红综色变浅,(2)中红棕色变深 | ||
| C. | 烧瓶(1)中气体的压强不变 | D. | 烧瓶(2)中气体的压强增大 |
6.下列有关电子排布图的表述正确的是( )
| A. | 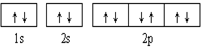 可表示单核10电子粒子基态时电子排布 可表示单核10电子粒子基态时电子排布 | |
| B. | 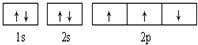 此图错误,违背了泡利原理 此图错误,违背了泡利原理 | |
| C. | 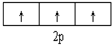 表示基态N原子的价电子排布 表示基态N原子的价电子排布 | |
| D. |  表示处于激发态的B的电子排布图 表示处于激发态的B的电子排布图 |
7.某科研单位利用石油裂解的副产物CH4来制取CO和H2,其生产流程如图1:
(1)该流程第Ⅰ步反应为:CH4(g)+H2O(g)?CO(g)+3H2(g),一定条件下CH4的平衡转化率与温度、压强的关系如图2.则P1<P2.(填“<”、“>”或“=”).该反应的平衡常数的表达式K=$\frac{c(CO){c}^{3}({H}_{2})}{c(C{H}_{4})c({H}_{2}O)}$.
(2)此流程的第Ⅱ步反应的平衡常数随温度的变化如表:
①从上表分析推断,该反应是△H<0(填“<”、“>”或“=”).
②在500℃时,设起始时CO和H2O的起始浓度均为0.010mol/L-1,在该条件下,反应达到平衡时,CO的转化率为75%.
③如图3表示该反应在t1时刻达到平衡,在t2时刻因改变某个条件浓度发生变化的情况:图中t2时刻发生改变的条件可能是降低温度,或增加水蒸汽的量,或减少氢气的量(写出两种).
(1)该流程第Ⅰ步反应为:CH4(g)+H2O(g)?CO(g)+3H2(g),一定条件下CH4的平衡转化率与温度、压强的关系如图2.则P1<P2.(填“<”、“>”或“=”).该反应的平衡常数的表达式K=$\frac{c(CO){c}^{3}({H}_{2})}{c(C{H}_{4})c({H}_{2}O)}$.
(2)此流程的第Ⅱ步反应的平衡常数随温度的变化如表:
| 温度/℃ | 300 | 500 | 830 |
| 平衡常数K | 12 | 9 | 1 |
②在500℃时,设起始时CO和H2O的起始浓度均为0.010mol/L-1,在该条件下,反应达到平衡时,CO的转化率为75%.
③如图3表示该反应在t1时刻达到平衡,在t2时刻因改变某个条件浓度发生变化的情况:图中t2时刻发生改变的条件可能是降低温度,或增加水蒸汽的量,或减少氢气的量(写出两种).

 ,
,