题目内容
9.下列化学用语表示正确的是( )| A. | 中子数为8的氮原子:${\;}_{8}^{15}$N | B. | 硫离子的结构示意图: | ||
| C. | 铵根离子的电子式: | D. | 聚丙烯的结构简式 |
分析 A.左下角为质子数;
B.硫离子核内有16个质子;
C.铵根离子为阳离子,带一个单位的正电荷,氮原子与四个氢原子分别共用1对电子;
D.聚丙烯的结构单元的主链含有2个C原子.
解答 解:A.中子数为8的氮原子质量数为15,原子符号为:715N,故A错误;
B.硫离子核内有16个质子,结构示意图为: ,故B错误;
,故B错误;
C.铵根离子为阳离子,电子式: ,故C正确;
,故C正确;
D.聚丙烯为丙烯通过加聚反应生成的,聚丙烯的结构简式为: ,故D错误;
,故D错误;
故选:C.
点评 本题考查离子结构示意图,电子式、有机物结构简式等,掌握电子式、结构简式等化学用语的概念及正确的表示方法是解题管就,题目难度不大.

练习册系列答案
相关题目
19.下列叙述正确的是( )
| A. | 聚氯乙烯与乙烯性质相似,可使溴水褪色 | |
| B. | 甲烷和Cl2的反应与乙烯和Br2的反应属于同一类型的反应 | |
| C. | C4H9Cl有4种同分异构体 | |
| D. | 分子式为C3H6、C6H12的两种有机物一定是同系物 |
20.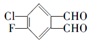 分子被称为“福禄双全宝宝”.苯环上连一个氟原子、一个氯原子、两个邻位醛基的其他“福禄双全宝宝”还有几种( )
分子被称为“福禄双全宝宝”.苯环上连一个氟原子、一个氯原子、两个邻位醛基的其他“福禄双全宝宝”还有几种( )
 分子被称为“福禄双全宝宝”.苯环上连一个氟原子、一个氯原子、两个邻位醛基的其他“福禄双全宝宝”还有几种( )
分子被称为“福禄双全宝宝”.苯环上连一个氟原子、一个氯原子、两个邻位醛基的其他“福禄双全宝宝”还有几种( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
17.某含C、H、O三种元素的未知物X,经实验测定该物质中元素的质量分数为碳72.0%,氢6.67%.另测得
X的相对分子质量为150.下列关于X的说法正确的是( )
X的相对分子质量为150.下列关于X的说法正确的是( )
| A. | 实验式和分子式均为C9H10O | |
| B. | 不可能含有苯环 | |
| C. | 1molX完全燃烧,可生成5mol水 | |
| D. | 若未测得X的相对分子质量,也能确定X的分子式 |
14.被称之为“软电池”的纸质电池,采用一个薄层纸片(在其一边镀锌,而在其另一边镀二氧化锰)作为传导体,在纸内的离子“流过”水和氧化锌组成的电解液.电池总反应为:Zn+2MnO2+H2O═ZnO+2MnO(OH),下列说法正确的是( )
| A. | 该电池的正极为锌,发生氧化反应 | |
| B. | 该电池反应中二氧化锰起催化剂作用 | |
| C. | 当0.1molZn完全溶解时,流经电解液的电子总数为1.204×1023 | |
| D. | 电池正极反应式为:2MnO2+2e-+2H2O═2MnO(OH)+2OH- |
1.下列化学式只代表一种物质分子的是( )
| A. | CH2Cl2 | B. | C2H4Cl2 | C. | C4H10 | D. | C5H12 |
18.下列有关说法正确的是( )
| A. | CuS、FeS、SO3、FeCl2均可由单质直接化合生成 | |
| B. | 硫在空气中的燃烧产物是SO2,在纯氧中的燃烧产物是SO3 | |
| C. | SO2使酸性KMnO4溶液褪色的原因是因为SO2具有还原性 | |
| D. | SO2和O2按物质的量之比2:1通入密闭容器中充分反应后,容器中只有SO3 |
19.低碳经济是以低能耗、低污染、低排放为基础的经济模式.低碳经济的概念在中国正迅速从高端概念演变成全社会的行为,在新能源汽车、工业节能等多个领域都大有作为. 请运用化学反应原理的相关知识研究碳及其化合物的性质.
(1)工业上可利用CO或CO2来制备清洁液体燃料甲醇.已知:800℃时,化学反应①、反应②对应的平衡常数分别为2.5、1.0.
反应①:2H2(g)+CO(g)?CH3OH(g)△H=-90.8kJ•mol-1
反应②:H2(g)+CO2(g)?H2O (g)+CO(g)△H=+41.2kJ•mol-1
写出用CO2与H2反应制备甲醇的热化学方程式3H2(g)+CO2(g)?CH3OH(g)+H2O(g)△H=-49.6kJ/mol,800℃时该反应的化学平衡常数K的数值为2.5.
现将不同量的CO2 (g)和H2(g)分别通入到容积为2L恒容密闭容器中进行反应②,得到如表二组数据:
实验2中,若平衡吋,CO2 (g)的转化率小于H2(g),则a、b必须满足的关系是a>b.
若在900℃时,另做一组实验,在此容器中加入10mol CO2,5mol H2,2mol CO,5mol H2O (g)(g),则此时v正>v逆(填“>”、“>”或“=”).
(2)工业上可通过甲醇羰基化法制取甲酸甲酯,其反应的热化学方程式为:CH3OH(g)+CO(g)→HCOOCH3(g)△H=-29.1KJ•mol-1,科研人员对该反应进行了研究,部分研究结果如下:

①从反应压强对甲醇转化率的影响“效率”看,工业制取甲酸甲酯应选择的压强是4.0×106Pa(填“3.5×106Pa”“4.0×106 Pa”或“5.0×106Pa”).
②实际工业生产中采用的温度是80℃,其理由是高于80℃时,温度对反应速率影响较小,且反应放热,升高温度时平衡逆向移动,转化率降低.
(3)已知常温下NH3•H2O的电离平衡常数K=1.75×10-5,H2CO3的电离平衡常数K1=4.4×10-7,K2=4.7×10-11.常温下,用氮水吸收CO2可得到NH4HCO3溶液,NH4HCO3溶液呈碱性(填“酸性”“中性”或“碱性”),溶液中离子浓度由大到小的顺序为:c(NH4+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-).
(1)工业上可利用CO或CO2来制备清洁液体燃料甲醇.已知:800℃时,化学反应①、反应②对应的平衡常数分别为2.5、1.0.
反应①:2H2(g)+CO(g)?CH3OH(g)△H=-90.8kJ•mol-1
反应②:H2(g)+CO2(g)?H2O (g)+CO(g)△H=+41.2kJ•mol-1
写出用CO2与H2反应制备甲醇的热化学方程式3H2(g)+CO2(g)?CH3OH(g)+H2O(g)△H=-49.6kJ/mol,800℃时该反应的化学平衡常数K的数值为2.5.
现将不同量的CO2 (g)和H2(g)分别通入到容积为2L恒容密闭容器中进行反应②,得到如表二组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO2 (g) | H2(g) | H2(g) | CO2 (g) | |||
| 1 | 900 | 4 | 6 | 1.6 | 2.4 | 2 |
| 2 | 900 | a | b | c | d | t |
若在900℃时,另做一组实验,在此容器中加入10mol CO2,5mol H2,2mol CO,5mol H2O (g)(g),则此时v正>v逆(填“>”、“>”或“=”).
(2)工业上可通过甲醇羰基化法制取甲酸甲酯,其反应的热化学方程式为:CH3OH(g)+CO(g)→HCOOCH3(g)△H=-29.1KJ•mol-1,科研人员对该反应进行了研究,部分研究结果如下:

①从反应压强对甲醇转化率的影响“效率”看,工业制取甲酸甲酯应选择的压强是4.0×106Pa(填“3.5×106Pa”“4.0×106 Pa”或“5.0×106Pa”).
②实际工业生产中采用的温度是80℃,其理由是高于80℃时,温度对反应速率影响较小,且反应放热,升高温度时平衡逆向移动,转化率降低.
(3)已知常温下NH3•H2O的电离平衡常数K=1.75×10-5,H2CO3的电离平衡常数K1=4.4×10-7,K2=4.7×10-11.常温下,用氮水吸收CO2可得到NH4HCO3溶液,NH4HCO3溶液呈碱性(填“酸性”“中性”或“碱性”),溶液中离子浓度由大到小的顺序为:c(NH4+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-).
