题目内容
(10分)某研究性学习小组,为了探究电极与原电池的电解质之间关系,设计了下列实验方案:用铝片、铜片、镁片作电极,分别与下列溶液构成原电池,并接电流表。
(1)若电解质溶液为0.5mol/L硫酸,电极为铜片和铝片,则电流计指针偏向 (填“铝”或“铜”)。
(2)若用浓硝酸作电解质溶液,电极为铜片和铝片,则电流计指针偏向 (填“铝”或“铜”),铝做 (填“正”或“负”),正极上电极反应式为:
(3)若电解质溶液为0.5mol/L氢氧化钠溶液,电极为镁片和铝片,则正极发生的电极反应为 。
通过上述实验探究,你受到的启示是
(1)若电解质溶液为0.5mol/L硫酸,电极为铜片和铝片,则电流计指针偏向 (填“铝”或“铜”)。
(2)若用浓硝酸作电解质溶液,电极为铜片和铝片,则电流计指针偏向 (填“铝”或“铜”),铝做 (填“正”或“负”),正极上电极反应式为:
(3)若电解质溶液为0.5mol/L氢氧化钠溶液,电极为镁片和铝片,则正极发生的电极反应为 。
通过上述实验探究,你受到的启示是
(10分)(1)铝; (2)铜;正, 2NO3-+2e-+4H+=2NO2↑+2H2O
(3)2H2O+2e-=2OH-+H2↑ 启示1,电极类型与电解质溶液性质有关;启示2,金属活泼性相对某溶液而言,不同的物质相对同一种金属,可能活泼性发生变化;启示3,根据电极类型比较金属活泼性不一定正确;启示4,可以通过电流流向确定金属的相对活泼性。
(3)2H2O+2e-=2OH-+H2↑ 启示1,电极类型与电解质溶液性质有关;启示2,金属活泼性相对某溶液而言,不同的物质相对同一种金属,可能活泼性发生变化;启示3,根据电极类型比较金属活泼性不一定正确;启示4,可以通过电流流向确定金属的相对活泼性。
试题分析:(1)电极为铜片和铝片,电解质为硫酸溶液时,负极为铝,电子的流动方向为负极到正极,电流的方向为正极到负极,故电流表指针偏向于铝;(2)浓硝酸做电解质溶液时,铝钝化,故铜做负极,电池反应为铜和浓硝酸反应,正极上是硝酸根离子得电子生成二氧化氮,电极反应式为:2NO3-+2e-+4H+=2NO2↑+2H2O;(3)电解质溶液为0.5mol/L氢氧化钠溶液,电极为镁片和铝片时,因为镁和氢氧化钠不反应,故负极为铝,电池反应为铝和氢氧化钠反应,故正极反应为:2H2O+2e-=2OH-+H2↑;本题的启示主要是负极材料不仅仅决定于金属的活动性,还要考虑电解质溶液,考虑电池反应。

练习册系列答案
相关题目


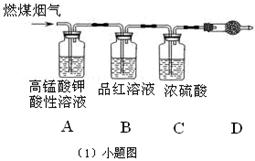


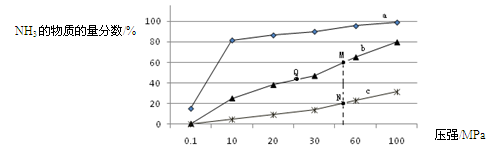

 LaNi5H+NiOOH。下列有关说法不正确的是
LaNi5H+NiOOH。下列有关说法不正确的是 2Ni(OH)2,根据此反应式判断,此电池放电时,正极上发生反应的物质是( )。
2Ni(OH)2,根据此反应式判断,此电池放电时,正极上发生反应的物质是( )。