��Ŀ����
����Ŀ����1���״�����ת��Ϊ������һ��ԭ����CH3OH��H2O��Ӧ����CO2��H2��
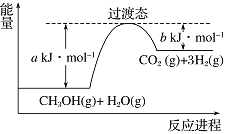
��ͼ�Ǹù����������仯ʾ��ͼ�����ڷ�Ӧ��ϵ�м����������Ӧ������������Ӧ���a�ı仯��___________������������������С������������������Ӧ����H�ı仯��________������������������С������������������д����Ӧ����CH3OH��g����H2O��g����Ӧ���Ȼ�ѧ����ʽ___________________��
��2��������������ɹ⻯ѧ�����ͳ�������ĵ���Ҫ���塣
��֪����CO��g��+NO2��g��=NO��g��+CO2��g�� ��H=-akJ��mol-1��a>0��
��2CO��g��+2NO��g��=N2��g��+2CO2��g�� ��H=-bkJ��mol-1��b>0��
���ñ�״����4.48 L CO��ԭNO2��N2��CO��ȫ��Ӧ��������������ת�Ƶ��ӵ����ʵ���Ϊ________���ų�������Ϊ________kJ���ú���a��b�Ĵ���ʽ��ʾ����
���𰸡�
��1����С�����䣻CH3OH��g��+H2O��g��=CO2��g��+3H2��g�� ��H=��a-b��kJ��mol-1��
��2��0.4mol����2a+b��/20
��������
�����������1���������ͷ�Ӧ�Ļ�ܣ��ӿ췴Ӧ���ʣ���a��С�����������ܸı䷴Ӧ�ȣ�����Ӧ����H���䣬��Ӧ����ͼ������������������ڷ�Ӧ�������������Ϊ���ȷ�Ӧ����ͼ��֪��1mol �״���1mol ˮ������Ӧ����CO2���������յ�����Ϊ��a-b��kJ����Ӧ�Ȼ�ѧ����ʽΪ��CH3OH��g��+H2O��g��=CO2��g��+3H2��g����H=+��a-b��kJ/mol��
��2����CO��g��+NO2��g��=NO��g��+CO2��g����H=-a KJmol-1��a��0����
��2CO��g��+2NO ��g��=N2��g��+2CO2��g����H=-b KJmol-1��b��0����
������ʽ�١�2+����4CO��g��+2NO2��g��=N2��g��+4CO2��g��
��H=��-a�� KJmol-1��2+��-b KJmol-1��=-��2a+b��KJmol-1���������Ȼ�ѧ��Ӧ����ʽΪ��
4CO��g��+2NO2��g��=N2��g��+4CO2��g����H=-��2a+b��KJmol-1�����ݷ���ʽ֪ת�Ƶ��ӵ����ʵ���
![]() ��2=0.4mol���ų�������=
��2=0.4mol���ų�������=![]() ��
��![]() =
=![]() kJ��
kJ��
�ʴ�Ϊ��0.4��![]() ��
��
