题目内容
火力发电厂产生大量的氮氧化物(NOx)、二氧化硫和二氧化碳等气体会造成环境污染.对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的.
(1)脱硝.利用甲烷催化还原NOx:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ?mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJ?mol-1
甲烷直接将NO2还原为N2的热化学方程式为
(2)脱碳.将CO2转化为甲醇的化学方程式为: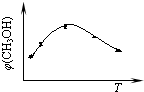
CO2+3H2 CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
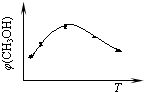
①取五份等体积CO2和H2的混合气体(物质的量之比均为1:3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,tmin后,测得甲醇的体积分数φ(CH3OH) 与反应温度T的关系曲线如图所示,则上述合成甲醇的反应的逆反应为
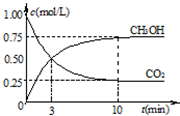
②在一恒温恒容密闭容器中充入1mol CO2和3mol H2,进行上述反应.测得CO2和CH3OH(g)的浓度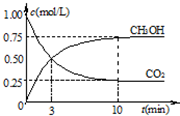 随时间变化如图所示.下列说法正确的是
随时间变化如图所示.下列说法正确的是
A.10min后,向该容器中再充入1mol CO2和3mol H2,则再次达到平衡时c(CH3OH)=1.5mol?L-1
B.0~10min内,氢气的平均反应速率为0.075mol?L-1?min-1
C.达到平衡时,氢气的转化率为75%
D.该温度下,反应的平衡常数的值为3/16
E.升高温度将使n(CH3OH)/n(CO2)减小
③能说明CO2(g)+3H2(g) CH3OH(g)+H2O(g)达到平衡状态的是
CH3OH(g)+H2O(g)达到平衡状态的是
A.生成甲醇的速率与生成水的速率相等
B.v(H2)=3v(CH3OH)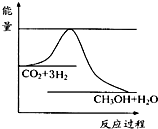
C.恒容容器中,体系的压强不再改变
D.恒容容器中,混合气体密度不再发生改变
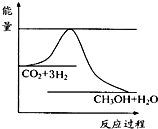
④右图表示反应CO2(g)+3H2(g) CH3OH(g)+H2O(g)进行过程中能量(单位为kJ?mol-1)的变化.在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,达到平衡后,采取下列措施中能使c(CH3OH)增大的是
CH3OH(g)+H2O(g)进行过程中能量(单位为kJ?mol-1)的变化.在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,达到平衡后,采取下列措施中能使c(CH3OH)增大的是
A.使用新高效催化剂 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离出来 D.再充入1mol CO2和3mol H2
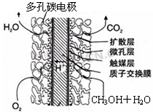
⑤甲醇燃料电池结构如图所示,其工作时正极的电极反应式可表示为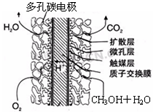
(3)脱硫.某种脱硫工艺中将废气经处理后,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物作为副产品化肥.
硫酸铵溶液的pH<7,其原因为:
(1)脱硝.利用甲烷催化还原NOx:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ?mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJ?mol-1
甲烷直接将NO2还原为N2的热化学方程式为
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867kJ/mol
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867kJ/mol
.(2)脱碳.将CO2转化为甲醇的化学方程式为:

CO2+3H2
 CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)①取五份等体积CO2和H2的混合气体(物质的量之比均为1:3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,tmin后,测得甲醇的体积分数φ(CH3OH) 与反应温度T的关系曲线如图所示,则上述合成甲醇的反应的逆反应为
吸热
吸热
反应(填“放热”或“吸热”).②在一恒温恒容密闭容器中充入1mol CO2和3mol H2,进行上述反应.测得CO2和CH3OH(g)的浓度
 随时间变化如图所示.下列说法正确的是
随时间变化如图所示.下列说法正确的是CE
CE
A.10min后,向该容器中再充入1mol CO2和3mol H2,则再次达到平衡时c(CH3OH)=1.5mol?L-1
B.0~10min内,氢气的平均反应速率为0.075mol?L-1?min-1
C.达到平衡时,氢气的转化率为75%
D.该温度下,反应的平衡常数的值为3/16
E.升高温度将使n(CH3OH)/n(CO2)减小
③能说明CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)达到平衡状态的是
CH3OH(g)+H2O(g)达到平衡状态的是C
C
A.生成甲醇的速率与生成水的速率相等
B.v(H2)=3v(CH3OH)

C.恒容容器中,体系的压强不再改变
D.恒容容器中,混合气体密度不再发生改变
④右图表示反应CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)进行过程中能量(单位为kJ?mol-1)的变化.在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,达到平衡后,采取下列措施中能使c(CH3OH)增大的是
CH3OH(g)+H2O(g)进行过程中能量(单位为kJ?mol-1)的变化.在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,达到平衡后,采取下列措施中能使c(CH3OH)增大的是CD
CD
.A.使用新高效催化剂 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离出来 D.再充入1mol CO2和3mol H2
⑤甲醇燃料电池结构如图所示,其工作时正极的电极反应式可表示为
O2+4e-+4H+=2H2O
O2+4e-+4H+=2H2O
.
(3)脱硫.某种脱硫工艺中将废气经处理后,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物作为副产品化肥.
硫酸铵溶液的pH<7,其原因为:
NH4++H2O NH3?H2O+H+
NH3?H2O+H+
 NH3?H2O+H+
NH3?H2O+H+NH4++H2O NH3?H2O+H+
NH3?H2O+H+
(用离子方程式表示);在一定物质的量浓度的硝酸铵溶液中滴加适量的NaOH溶液,使溶液的pH=7,则溶液中c(Na+) NH3?H2O+H+
NH3?H2O+H+小于
小于
c(NO3-)(选填“大于”、“等于”或“小于”)分析:(1)根据已知反应和目标反应及盖斯定律来计算反应热,并书写热化学反应方程式;
(2)①由图可知,最高点以后随温度的升高,甲醇的体积分数减小,则正反应为放热反应;
②根据化学平衡的三段法计算来分析;
③根据化学平衡的特征“等”与“定”来分析;
④能使c(CH3OH)增大,则化学平衡应正向移动,以此来分析;
⑤甲醇燃料电池中,负极为甲醇,正极为氧气,正极发生还原反应;
(3)硫酸铵溶液的pH<7,利用盐类水解来分析;硝酸铵溶液中滴加适量的NaOH溶液,使溶液的pH=7,利用电荷守恒来分析离子浓度的关系.
(2)①由图可知,最高点以后随温度的升高,甲醇的体积分数减小,则正反应为放热反应;
②根据化学平衡的三段法计算来分析;
③根据化学平衡的特征“等”与“定”来分析;
④能使c(CH3OH)增大,则化学平衡应正向移动,以此来分析;
⑤甲醇燃料电池中,负极为甲醇,正极为氧气,正极发生还原反应;
(3)硫酸铵溶液的pH<7,利用盐类水解来分析;硝酸铵溶液中滴加适量的NaOH溶液,使溶液的pH=7,利用电荷守恒来分析离子浓度的关系.
解答:解:(1)由①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ?mol-1,
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJ?mol-1,
根据盖斯定律可知,
可得CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g),
则△H=
=-867 kJ/mol,
即热化学反应方程式为CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867 kJ/mol,
故答案为:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867 kJ/mol;
(2)①由图可知,最高点以后随温度的升高,甲醇的体积分数减小,则正反应为放热反应,则该反应的逆反应为吸热反应,
故答案为:吸热;
②CO2+3H2 CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
开始 1 3 0 0
转化0.75 2.25 0.75 0.75
平衡 0.25 0.75 0.75 0.75
A.10min后,向该密闭容器中再充入1mol CO2和3molH2,化学平衡正向移动,则再次达到平衡时
c(CH3OH)>1.5mol?L-1,故A错误;
B.0~10min内,氢气的平均反应速率为
=0.225mol?L-1?min-1,故B错误;
C.达到平衡时,氢气的转化率为
×100%=75%,故C正确;
D.该温度下,反应的平衡常数的值为
=3,故D错误;
E.该反应为放热反应,升高温度化学平衡逆向移动,则将使n(CH3OH)/n(CO2)减小,故E正确;
故答案为:CE;
③A.生成甲醇的速率与生成水的速率相等,只能说明正反应的关系,无法确定正逆反应速率的关系,故A错误;
B.由v(H2)=3v(CH3OH)可知,反应速率之比等于化学计量数之比,但无法确定是否达到平衡,故B错误;
C.该反应为反应前后体积不等的反应,则在恒容容器中,体系的压强不再改变,化学反应达到平衡,故C正确;
D.恒容容器中,混合气体密度不再发生改变,因质量与体积始终不变,则密度一直不变,不能作为判断平衡的方法,故D错误;
故答案为:C;
④A.使用新高效催化剂,化学平衡不移动,则c(CH3OH)不变,故A错误;
B.充入He(g),使体系压强增大,但体积不变,反应体系中的浓度不变,化学平衡不移动,故B错误;
C.将H2O(g)从体系中分离出来,能使化学平衡正向移动,使c(CH3OH)增大,故C正确;
D.再充入1mol CO2和3molH2,压强增大,化学平衡正向移动,则c(CH3OH)增大,故D正确;
故答案为:CD;
⑤甲醇燃料电池中,正极为氧气,正极发生还原反应,则正极反应式为O2+4e-+4H+=2H2O,故答案为:O2+4e-+4H+=2H2O;
(3)由题意可知,硫酸铵溶液的pH<7,硫酸铵为强酸弱碱盐,则铵根离子水解显酸性,水解离子反应为NH4++H2O NH3?H2O+H+,
NH3?H2O+H+,
硝酸铵溶液中滴加适量的NaOH溶液,由电荷守恒可知,c(NH4+)+c(Na+)+c(H+)=c(NO3-)+c(OH-),而pH=7,则c(H+)=c(OH-),
所以c(NH4+)+c(Na+)=c(NO3-),即c(Na+)<c(NO3-),故答案为:NH4++H2O NH3?H2O+H+;小于.
NH3?H2O+H+;小于.
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJ?mol-1,
根据盖斯定律可知,
| ①+② |
| 2 |
则△H=
| △H1+△H2 |
| 2 |
即热化学反应方程式为CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867 kJ/mol,
故答案为:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867 kJ/mol;
(2)①由图可知,最高点以后随温度的升高,甲醇的体积分数减小,则正反应为放热反应,则该反应的逆反应为吸热反应,
故答案为:吸热;
②CO2+3H2
 CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)开始 1 3 0 0
转化0.75 2.25 0.75 0.75
平衡 0.25 0.75 0.75 0.75
A.10min后,向该密闭容器中再充入1mol CO2和3molH2,化学平衡正向移动,则再次达到平衡时
c(CH3OH)>1.5mol?L-1,故A错误;
B.0~10min内,氢气的平均反应速率为
| 2.25mol/L |
| 10min |
C.达到平衡时,氢气的转化率为
| 2.25mol/L |
| 3mol/L |
D.该温度下,反应的平衡常数的值为
| 0.75×0.75 |
| 0.25×0.75 |
E.该反应为放热反应,升高温度化学平衡逆向移动,则将使n(CH3OH)/n(CO2)减小,故E正确;
故答案为:CE;
③A.生成甲醇的速率与生成水的速率相等,只能说明正反应的关系,无法确定正逆反应速率的关系,故A错误;
B.由v(H2)=3v(CH3OH)可知,反应速率之比等于化学计量数之比,但无法确定是否达到平衡,故B错误;
C.该反应为反应前后体积不等的反应,则在恒容容器中,体系的压强不再改变,化学反应达到平衡,故C正确;
D.恒容容器中,混合气体密度不再发生改变,因质量与体积始终不变,则密度一直不变,不能作为判断平衡的方法,故D错误;
故答案为:C;
④A.使用新高效催化剂,化学平衡不移动,则c(CH3OH)不变,故A错误;
B.充入He(g),使体系压强增大,但体积不变,反应体系中的浓度不变,化学平衡不移动,故B错误;
C.将H2O(g)从体系中分离出来,能使化学平衡正向移动,使c(CH3OH)增大,故C正确;
D.再充入1mol CO2和3molH2,压强增大,化学平衡正向移动,则c(CH3OH)增大,故D正确;
故答案为:CD;
⑤甲醇燃料电池中,正极为氧气,正极发生还原反应,则正极反应式为O2+4e-+4H+=2H2O,故答案为:O2+4e-+4H+=2H2O;
(3)由题意可知,硫酸铵溶液的pH<7,硫酸铵为强酸弱碱盐,则铵根离子水解显酸性,水解离子反应为NH4++H2O
 NH3?H2O+H+,
NH3?H2O+H+,硝酸铵溶液中滴加适量的NaOH溶液,由电荷守恒可知,c(NH4+)+c(Na+)+c(H+)=c(NO3-)+c(OH-),而pH=7,则c(H+)=c(OH-),
所以c(NH4+)+c(Na+)=c(NO3-),即c(Na+)<c(NO3-),故答案为:NH4++H2O
 NH3?H2O+H+;小于.
NH3?H2O+H+;小于.点评:本题综合性强,难度较大,主要考查反应热、化学平衡、原电池、盐类水解等知识,注重对高考考点的考查,(2)为学生解答的难度和易错点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目



 CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g) CH3OH(g)+H2O(g)达到平衡状态的是______
CH3OH(g)+H2O(g)达到平衡状态的是______ CH3OH(g)+H2O(g)进行过程中能量的变化.在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,达到平衡后,采取下列措施中能使c(CH3OH)增大的是______.
CH3OH(g)+H2O(g)进行过程中能量的变化.在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,达到平衡后,采取下列措施中能使c(CH3OH)增大的是______.


