题目内容
 12.0g某液态有机化合物A完全燃烧后,生成14.4gH2O和26.4g CO2.测得有机化合物A的蒸气与H2的相对密度是30,求:
12.0g某液态有机化合物A完全燃烧后,生成14.4gH2O和26.4g CO2.测得有机化合物A的蒸气与H2的相对密度是30,求:(1)有机物A的分子式
C3H8O
C3H8O
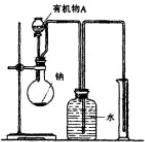
.(2)用如图所示装置测定有机物A的分子结构,实验数据如下(实验数据均已换算为标准状况):a mL(密度为ρg/cm3)的有机物A与足量钠完全反应后,量筒液面读数为bmL,若1mol A分子中有x mol氢原子能跟金属钠反应,则x的计算式为
| 2×60b |
| 22.4aρ×1000 |
| 3b |
| 560aρ |
| 2×60b |
| 22.4aρ×1000 |
| 3b |
| 560aρ |
分析:(1)由n=
=
可知,ρ=
=
,在相同条件下气体的相对分子质量之比等于密度之比,该化合物的蒸气对氢气的相对密度为30,则该化合物的相对分子质量为30×2=60,根据有机物的质量计算出有机物的物质的量,根据生成水和二氧化碳的物质的量结合质量守恒可计算出该有机物的分子式为C3H8O,
(2)根据反应为C3H8O+xNa→C3H(8-x)ONa+
H2↑来计算x值.
| m |
| M |
| V |
| Vm |
| m |
| V |
| M |
| Vm |
(2)根据反应为C3H8O+xNa→C3H(8-x)ONa+
| x |
| 2 |
解答:解:(1)由n=
=
可知,ρ=
=
,在相同条件下气体的相对分子质量之比等于密度之比,该化合物的蒸气对氢气的相对密度为30,
则该化合物的相对分子质量为30×2=60,
则:n(有机化合物)=
=0.2mol,
n(H2O)=
=0.8mol,
n(CO2)=
=0.6mol,
12.0g有机物中含有:m(C)=0.6mol×12g/mol=7.2g,
m(H)=2×0.8mol×1g/mol=1.6g,
则m(O)=12.0g-7.2g-1.6g=3.2g,
n(O)=
=0.2mol,
所以有机物中含有:N(C)=
=3,N(H)=
=8,N(O)=
=1,
则有机物分子式为C3H8O,
故答案为:C3H8O;
(2)amL(密度为ρg/cm3)的有机物A的质量为:m=aρg,
物质的量为:
=
mol,
量筒液面读数为bml,即生成氢气的体积为bml,则n(H2)=
mol,
则C3H8O+xNa→C3H(8-x)ONa+
H2↑
1
mol
mol
mol
解之得:x=
或x=
,
故答案为:
或x=
.
| m |
| M |
| V |
| Vm |
| m |
| V |
| M |
| Vm |
则该化合物的相对分子质量为30×2=60,
则:n(有机化合物)=
| 12.0g |
| 60g/mol |
n(H2O)=
| 14.4g |
| 18g/mol |
n(CO2)=
| 26.4g |
| 44g/mol |
12.0g有机物中含有:m(C)=0.6mol×12g/mol=7.2g,
m(H)=2×0.8mol×1g/mol=1.6g,
则m(O)=12.0g-7.2g-1.6g=3.2g,
n(O)=
| 3.2g |
| 16g/mol |
所以有机物中含有:N(C)=
| 0.6mol |
| 0.2mol |
| 1.6mol |
| 0.2mol |
| 0.2mol |
| 0.2mol |
则有机物分子式为C3H8O,
故答案为:C3H8O;
(2)amL(密度为ρg/cm3)的有机物A的质量为:m=aρg,
物质的量为:
| aρg |
| 60g/mol |
| aρ |
| 60 |
量筒液面读数为bml,即生成氢气的体积为bml,则n(H2)=
| b×10-3 |
| 22.4 |
则C3H8O+xNa→C3H(8-x)ONa+
| x |
| 2 |
1
| x |
| 2 |
| aρ |
| 60 |
| b×10-3 |
| 22.4 |
解之得:x=
| 2×60b |
| 22.4aρ×1000 |
| 3b |
| 560aρ |
故答案为:
| 2×60b |
| 22.4aρ×1000 |
| 3b |
| 560aρ |
点评:本题考查有机物分子式的确定,题目难度中等,本题中(2)题计算时注意从反应的化学方程式的角度解答.

练习册系列答案
 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案
相关题目