题目内容
【题目】室温时,在20mL 0.1molL-1一元弱酸HA溶液中滴加同浓度的NaOH溶液,溶液中![]() 与pH的关系如图所示。下列说法正确的是
与pH的关系如图所示。下列说法正确的是
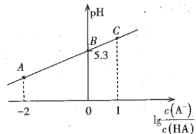
A.室温时,电离常数Ka(HA)=1.0×10-5.3
B.B点对应NaOH溶液的体积是10mL
C.A点溶液中:c(Na+)> c(A-)> c(H+)> c(OH-)
D.从A点到C点的过程中,水的电离程度先增大后减小
【答案】A
【解析】
A.室温时,在B点,pH=5.3,c(H+)=10-5.3,![]() =0,则
=0,则![]() =1
=1
电离常数Ka(HA)=![]() =
= ![]() =1.0×10-5.3,A正确;
=1.0×10-5.3,A正确;
B.B点的平衡溶液中,c(A-)=c(HA),依据电荷守恒,c(Na+)+c(H+)=c(A-)+c(OH-),由于pH=5.3,所以c(H+)> c(OH-),c(Na+)<c(A-),故V(NaOH)<10mL,B不正确;
C.c(Na+)>c(A-)>c(H+)>c(OH-)显然不符合电荷守恒原则,C不正确;
D.从A点到C点的过程中,c(A-)不断增大,水的电离程度不断增大,D不正确;
故选A。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目