题目内容
某学习兴趣小组探究氨气的制取实验:
(1)甲同学拟用下列实验方法制备氨气,其中合理的是 (填序号,下同)。
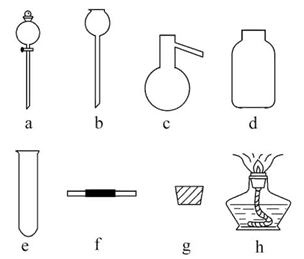
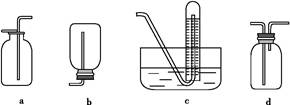
(2)如图是甲同学设计收集氨气的几种装置,其中可行的是 ,集气的原理是 。
(1)甲同学拟用下列实验方法制备氨气,其中合理的是 (填序号,下同)。
| A.将氯化铵固体加热分解 |
| B.将浓氨水滴入氢氧化钠固体中 |
| C.将氢氧化钠固体加入浓氨水中 |
| D.将氯化铵稀溶液滴入氢氧化钠固体中 |

(1)B
(2)d 利用氨气密度小于空气,采用短管进氨气,长管出空气,即可收集氨气
(2)d 利用氨气密度小于空气,采用短管进氨气,长管出空气,即可收集氨气
(1)加热氯化铵产生氯化氢和氨气,遇冷又转化为氯化铵固体,不能制取氨气;用浓氨水与氢氧化钠固体混合制氨气时,将氨水滴入氢氧化钠固体中更方便操作,而且节约氨水的用量;氨气极易溶于水,若用稀溶液制取,产量较少。(2)氨气极易溶于水,采用向下排空气法收集。

练习册系列答案
相关题目