题目内容
常温下在20 mL 0.1 mol/L Na2CO3溶液中逐渐滴加入0.1 mol/L HCl溶液40 mL,溶液的pH逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变化(CO2因逸出未画出),如图所示,下列说法不正确的是


| A.0.1 mol/L Na2CO3溶液中c(OH-)-c(H+)=2c(H2CO3)+c(HCO3-) |
| B.在A点c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
| C.常温下CO2饱和溶液的pH约为5.6 |
| D.0.05 mol/L NaHCO3溶液的pH=8 |
B
选项A符合质子守恒,正确。碳酸钠和盐酸反应是分步进行的,反应式为Na2CO3+HCl
=NaHCO3+NaCl、NaHCO3+HCl=NaCl+CO2↑+H2O。根据图像可知,A点CO32-和HCO3-的含量是相同的,所以选项B不正确。在C点CO32-和HCO3-的含量接近0,此时是CO2的饱和溶液,溶液的pH=5.6,所以选项C正确。当溶液中CO32-的含量为0时,溶液中只有溶质NaHCO3,其浓度是0.05mol/L,根据图像可知,此时溶液的pH=8,D正确。答案选B。
=NaHCO3+NaCl、NaHCO3+HCl=NaCl+CO2↑+H2O。根据图像可知,A点CO32-和HCO3-的含量是相同的,所以选项B不正确。在C点CO32-和HCO3-的含量接近0,此时是CO2的饱和溶液,溶液的pH=5.6,所以选项C正确。当溶液中CO32-的含量为0时,溶液中只有溶质NaHCO3,其浓度是0.05mol/L,根据图像可知,此时溶液的pH=8,D正确。答案选B。

练习册系列答案
相关题目
 溶液(约1mol/L)、
溶液(约1mol/L)、 溶液(约1mol/L)及发泡剂.使用时发生的化学反应方程式是__________________________.
溶液(约1mol/L)及发泡剂.使用时发生的化学反应方程式是__________________________. 代替
代替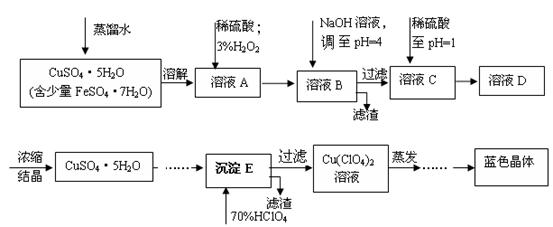
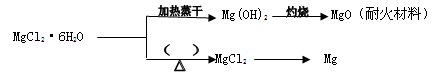
 Mg2++2OH-。向体系中加入(请填出两种不同类别的物质)_____________________________________________________ 有利于Mg(OH)2溶解。
Mg2++2OH-。向体系中加入(请填出两种不同类别的物质)_____________________________________________________ 有利于Mg(OH)2溶解。