题目内容
 某校一化学实验小组通过实验分析,确定一红色粉末为Fe2O3和Cu2O的混合物.
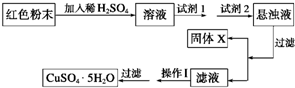
某校一化学实验小组通过实验分析,确定一红色粉末为Fe2O3和Cu2O的混合物.己知:①Cu2O溶于稀硫酸生成Cu和CuSO4,②Cu2O在空气中加热生成CuO.
(1)实验小组欲用加热法测定Cu2O的质量分数.取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为b g(b>a),则混合物中Cu2O的质量分数为
| 100(b-a) |
| a |
| 100(b-a) |
| a |
(2)实验小组欲利用该红色粉末制取较纯净的胆矾(CuSO4?5H2O).经查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH如下:
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | 供选择试剂 | |
| Fe3+ | 1.9 | 3.7 | A.氯水,B.H2O2, C.NaOH,D.氨水, E.CuO,F.Cu2(OH)2CO3 |
| Fe2+ | 7.5 | 11 | |
| Cu2+ | 6.0 | 10 |
试回答:
①试剂1可以为
②固体X的化学式为
③操作Ⅰ为
(2)根据表可知,Fe(OH)3完全沉淀时,pH最小,故应将Fe2+先转化为Fe3+,在利用增大pH的方法除去溶液中的Fe3+,但是所加物质不能增加新的杂质.
144g 16 g
m(Cu2O) (b-a) g
m(Cu2O)=
| 144g×(b-a)g |
| 16g |
故混合物中Cu2O的质量分数为:
| 9(b-a)g |
| ag |
| 100(b-a) |
| a |
故答案为:
| 100(b-a) |
| a |
(2)根据表可知,Fe(OH)3完全沉淀时,pH最小,故应将Fe2+先转化为Fe3+,在利用增大pH的方法除去溶液中的Fe3+,但是所加物质不能增加新的杂质,故第一步氧化剂应是H2O2,再加入Cu2(OH)2CO3或CuO调节pH,使溶液中的Fe3+生成沉淀除去.滤液成分为硫酸铜,经加热蒸发浓缩、冷却结晶,过滤后可得五水硫酸铜晶体,
故答案为:①B;EF;②Fe(OH)3;③蒸发浓缩、冷却结晶.

I.某校化学实验小组探究浓度对化学反应速率的影响,并测定![]() 和KI反应的化学反应速率。进行如下实验探究:
和KI反应的化学反应速率。进行如下实验探究:
【实验原理】
![]() 和KI反应的离子方程式为:
和KI反应的离子方程式为:
![]() (1)
(1)
平均反应速率的计算式为![]() 。
。
实验时,向![]() 、
、![]() 和淀粉指示剂混合溶液中加入
和淀粉指示剂混合溶液中加入![]() 溶液,不断搅拌。在反应(1)进行的同时,发生反应:
溶液,不断搅拌。在反应(1)进行的同时,发生反应:
![]() (2)
(2)
反应(1)生成的![]() 立即与
立即与![]() 反应,生成无色的
反应,生成无色的![]() 和
和![]() 。
。![]() 耗尽时,反应(1)继续生成的
耗尽时,反应(1)继续生成的![]() 才与淀粉作用呈现蓝色。从加入
才与淀粉作用呈现蓝色。从加入![]() 溶液到出现蓝色的时间为
溶液到出现蓝色的时间为![]() 。
。
【实验内容】
(1)实验小组设计的实验记录表和数据记录如下,请将表中字母表示的空格填上。
| 实验编号 | ①[来源:Z。xx。k.Com] | ② | ③ | ④ | ⑤ | |
| 试剂[来源:学&科&网Z&X&X 用量 (mL) | 0.20 mol·L | 20.0 | 10.0[ | b | 20.0 | 20.0 |
| 0.20 mol·L | 20.0 | 20.0 | 20.0 | 10.0 | 5.0 | |
| 0.010 mol·L | a | 8.0 | 8.0 | 8.0 | 8.0 | |
| 0.2%淀粉溶液 | 2.0 | 2.0 | 2.0 | 2.0 | 2.0 | |
| 0.20 mol·L | 0 | 0 | 0 | 10.0 | c | |
| 0.20 mol·L | 0 | 10.0 | 15.0 | 0 | 0 | |
| 20℃时,反应时间 | 32 | 67 | 130 | 66 | 135 | |
| 为了使溶液的离子强度和总体积保持不变,减少的(NH4)2S2O8溶液或KI溶液的用量,分别用(NH4)2SO4溶液或KNO3溶液补足;溶液混合后体积不变 | ||||||
(2)为了使反应充分进行,减少数据误差,实验过程中应该不断进行的操作是 。
(3)第①组实验的![]() mol·(L·s)
mol·(L·s)![]() 。
。
(4)根据上表数据分析,可以得到的结论有(写出一条即可) 。
II.实验小组查资料得知,向含有NaCO3的Na2S溶液中通入SO2,可以制备上述实验所需的Na2S2O3。反应如下:
![]()
![]()
![]()
该小组根据上述原理设计如图19所示装置制备![]() 。
。

(1)实验应避免有害气体排放到空气中。装置①、②中盛放的试剂依次是① ;
② 。
(2)实验过程中,随着气体的通入,装置①中有大量黄色固体析出,继续通入气体,可以观察到的现象是 。
(3)反应结束后,从制得的![]() 稀溶液中得到
稀溶液中得到![]() 晶体的主要操作包括: 。
晶体的主要操作包括: 。
I.某校化学实验小组探究浓度对化学反应速率的影响,并测定![]() 和KI反应的化学反应速率。进行如下实验探究:
和KI反应的化学反应速率。进行如下实验探究:
【实验原理】
![]() 和KI反应的离子方程式为:
和KI反应的离子方程式为:
![]() (1)
(1)
平均反应速率的计算式为![]() 。
。
实验时,向![]() 、
、![]() 和淀粉指示剂混合溶液中加入
和淀粉指示剂混合溶液中加入![]() 溶液,不断搅拌。
溶液,不断搅拌。
在反应(1)进行的同时,发生反应:
![]() (2)
(2)
反应(1)生成的![]() 立即与
立即与![]() 反应,生成无色的
反应,生成无色的![]() 和
和![]() 。
。![]() 耗尽时,反应(1)继续生成的
耗尽时,反应(1)继续生成的![]() 才与淀粉作用呈现蓝色。从加入
才与淀粉作用呈现蓝色。从加入![]() 溶液到出现蓝色的时间为
溶液到出现蓝色的时间为![]() 。
。
【实验内容】
(1)实验小组设计的实验记录表和数据记录如下,请将表中字母表示的空格填上。
| 实验编号 | ① | ② | ③ | ④ | ⑤ | |
| 试剂 用量 (mL) | 0.20 mol·L | 20.0 | 10.0 | b | 20.0 | 20.0 |
| 0.20 mol·L | 20.0 | 20.0 | 20.0 | 10.0 | 5.0 | |
| 0.010 mol·L | a | 8.0 | 8.0 | 8.0 | 8.0 | |
| 0.2%淀粉溶液 | 2.0 | 2.0 | 2.0 | 2.0 | 2.0 | |
| 0.20 mol·L | 0 | 0 | 0 | 10.0 | c | |
| 0.20 mol·L | 0 | 10.0 | 15.0 | 0 | 0 | |
| 20℃时,反应时间 | 32 | 67 | 130 | 66 | 135 | |
| 为了使溶液的离子强度和总体积保持不变,减少的(NH4)2S2O8溶液或KI溶液的用量,分别用(NH4)2SO4溶液或KNO3溶液补足;溶液混合后体积不变 | ||||||
(2)为了使反应充分进行,减少数据误差,实验过程中应该不断进行的操作是 。
(3)第①组实验的![]() mol·(L·s)
mol·(L·s)![]() 。
。
(4)根据上表数据分析,可以得到的结论有(写出一条即可) 。
II.实验小组查资料得知,向含有NaCO3的Na2S溶液中通入SO2,可以制备上述实验所需的Na2S2O3。反应如下:
![]()
![]()
![]()
该小组根据上述原理设计如图19所示装置制备![]() 。
。

(1)实验应避免有害气体排放到空气中。装置①、②中盛放的试剂依次是① ;② 。
(2)实验过程中,随着气体的通入,装置①中有大量黄色固体析出,继续通入气体,可以观察到的现象是 。
(3)反应结束后,从制得的![]() 稀溶液中得到
稀溶液中得到![]() 晶体的主要操作包括: 。
晶体的主要操作包括: 。
(13分)I.某校化学实验小组探究浓度对化学反应速率的影响,并测定(NH4)2S2O8和KI反应的化学反应速率。进行如下实验探究:
【实验原理】
(NH4)2S2O8和KI反应的离子方程式为:S2O82- + 2I-= 2SO42- + I2 (1)
平均反应速率的计算式为v(S2O82-)= 。
实验时,向KI、Na2S2O3和淀粉指示剂混合溶液中加入(NH4)2S2O8溶液,不断搅拌。
在反应(1)进行的同时,发生反应:2S2O32-+ I2 = S4O62-+ 2I- (2)
反应(1)生成的I2立即与S2O32-反应,生成无色的S4O62-和I-。S2O32-耗尽时,反应(1)继续生成的I2才与淀粉作用呈现蓝色。从加入(NH4)2S2O8溶液到出现蓝色的时间为Δt。
【实验内容】
(1)实验小组设计的实验记录表和数据记录如下,请将表中字母表示的空格填上。
| 实 验 编 号 | ① | ② | ③ | ④ | ⑤ | |
|
试剂 用量 (mL) | 0.20 mol·L-1 (NH4)2S2O8溶液 | 20.0 | 10.0 | b | 20.0 | 20.0 |
| 0.20 mol·L-1 KI溶液 | 20.0 | 20.0 | 20.0 | 10.0 | 5.0 | |
| 0.010 mol·L-1 Na2S2O3溶液 | a | 8.0 | 8.0 | 8.0 | 8.0 | |
| 0.2% 淀粉溶液 | 2.0 | 2.0 | 2.0 | 2.0 | 2.0 | |
| 0.20 mol·L-1KNO3溶液 | 0 | 0 | 0 | 10.0 | c | |
| 0.20 mol·L-1(NH4)2SO4溶液 | 0 | 10.0 | 15.0 | 0 | 0 | |
| 20 ℃时,反应时间Δt(s) | 32 | 67 | 130 | 66 | 135 | |
| 为了使溶液的离子强度和总体积保持不变,减少的(NH4)2S2O8溶液或KI溶液的用量,分别用(NH4)2SO4溶液或KNO3溶液补足;溶液混合后体积不变 |
(2)为了使反应充分进行,减少数据误差,实验过程中应该不断进行的操作是 。
(3)第①组实验的v(S2O82-)= mol·(L·s)-1。
(4)根据上表数据分析,可以得到的结论有(写出一条即可)
。
II.实验小组查资料得知,向含有Na2CO3的Na2S溶液中通入SO2,可以制备上述实验所需的Na2S2O3。反应如下:Na2CO3+ SO2= Na2SO3 + CO2;2Na2S + 3SO2= 2Na2SO3 + 3S↓;
Na2SO3 + S= Na2S2O3。该小组根据上述原理设计下图所示装置制备Na2S2O3。
(1)实验应避免有害气体排放到空气中。装置①、②中盛放的试剂依次是
① ;
② 。
(2)实验过程中,随着气体的通入,装置①中有气泡产生,还有大量黄色固体析出,继续通入气体,可以观察到的现象是 。
(3)反应结束后,从制得的Na2S2O3稀溶液中得到Na2S2O3·5H2O晶体的主要操作包括: 。
某校化学实验小组同学进行有关NO2气体的系列实验。

(1)如上图所示,烧瓶中放有少量铜片,打开分液漏斗
的旋塞,加入过量浓硝酸,烧瓶中产生气体的颜色是 ,试管中收集的气体颜色是 ,用化学方程式表示其原因 ;
(2)将烧瓶浸入冰水中,烧瓶内气体颜色 (填“变深”、“不变”或“变浅”),使用化学用语和必要的文字说明颜色变化的原因 ;
(3)在80℃时,将0.40 mol N2O4气体充入2 L已经抽空的固定容积的密闭容器中发生反应,隔一段时间对该容器内的物质进行分析,得到如下数据:
|
时间(s) |
0 |
20 |
40 |
60 |
80 |
100 |
|
n(N2O4)/mol |
0.40 |
a |
0.20 |
c |
d |
e |
|
n(NO2)/mol |
0.00 |
0.24 |
b |
0.52 |
0.60 |
0.60 |
①计算a = ,此温度时该反应的平衡常数K= ;
②平衡后,向该容器中再充入0.2molN2O4气体,则N2O4的转化率 (填增大、减小或不变)
③改变条件使反应重新达到平衡,能使c(NO2)/c(N2O4)值变小的措施有(填序号) 。
A.增大N2O4的起始浓度 B.升高温度
C.使用高效催化剂 D.向混合气体中通入稀有气体
| Ⅰ:下列有关实验的描述不正确的是____(填序号); ①用盐酸标准溶液滴定待测的氢氧化钠溶液时,水洗后的酸式滴定管未经标准溶液润洗,则测定结果偏低。 ② 配制一定物质的量浓度的溶液时,俯视容量瓶的刻度线,会使配制的浓度偏高; ③ 将Fe2(SO4)3溶液加热蒸发至干并灼烧,最后得到红棕色粉末 ④ 硝酸钾过饱和溶液冷却未出现结晶时,可以用玻棒充分磨擦器皿壁促使晶体析出。 ⑤可用25ml酸式滴定管量取20.00mlKMnO4溶液 ⑥分别向体积和pH均相同的盐酸和醋酸中滴加等浓度的氢氧化钠溶液,完全中和时消耗的氢氧化钠溶液的体积一样多 Ⅱ:三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。某校一化学实验小组通 过实验来探究红色粉末是Fe2O3、Cu2O或二者混合物。探究过程如下: 查阅资料:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO。 提出假设 假设1:红色粉末是Fe2O3 假设2:红色粉末是Cu2O 假设3:红色粉末是Fe2O3和Cu2O的混合物 设计探究实验 取少量粉末放入足量稀硫酸中,在所得溶液中再滴加KSCN试剂。 (1)若假设1成立,则实验现象是_________________。 (2)若滴加KSCN试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗?_________________。简述你的理由(不需写出反应的方程式)___________________。 (3)若固体粉末完全溶解无固体存在,滴加KSCN试剂时溶液不变红色,则证明原固体粉末是____________,写出发生反应的离子方程式________________。 探究延伸 经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物。 (4)实验小组欲用加热法测定Cu2O的质量分数。取ag固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg(b>a),则混合物中Cu2O的质量分数为________。 (5)实验小组欲利用该红色粉末制取较纯净的胆矾(CuSO4·5H2O)。经查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH如下: | ||||||||||||
| ||||||||||||
| 实验室有下列试剂可供选择: A、氯水 B、H2O2 C、NaOH D、Cu2(OH)2CO3 实验小组设计如下方案 | ||||||||||||
 | ||||||||||||
| 试回答: ①试剂1为_______,试剂2为________(填字母)。 ②固体X的化学式为____________。 ③操作I为___________。 |