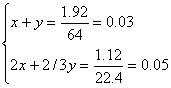题目内容
一定量的浓硝酸和1.92gCu反应,随着Cu的不断减少,反应生成的气体颜色逐渐变浅,当Cu反应完时,共收集气体的体积为1.12L(标准状况),求反应中消耗的硝酸物质的量是多少?
答案:0.11mol
解析:
解析:
此题有多种解法。首先分析气体颜色逐渐变浅的原因是浓HNO3在与Cu的反应过程中逐渐变稀,继而转化成稀HNO3与铜的反应。因此收集到气体为NO2和NO的混合气。 方法一:设Cu与浓HNO3、稀HNO3反应的物质的量分别为xmol和ymol Cu + 4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O 1mol 4mol 2mol xmol 4xmol 2xmol 3Cu + 8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O 3mol 8mol 2mol ymol 8/3y3mol 2/3ymol 依题意有: 解得x=0.0225mol y=0.0075mol ∴反应中消耗硝酸物质的量:4x+ 方法二:本题可从“原子守恒”角度分析提取关系式求解: Cu——Cu(NO3)2——2HNO3(酸性)
NOx(NO或NO2)——HNO3(被还原)
实际反应中HNO3由被还原的HNO3和体现酸性的HNO3两部分组成,应为0.06+0.05=0.11(mol)
|

练习册系列答案
相关题目