题目内容
【题目】有关能量转化的说法不正确的是
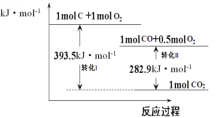
A.25℃时,碳的标准燃烧热:△H=-393.5kJ·mol-1
B.转化II的热化学方程式为:2CO(g)+O2(g)=2CO2(g)△H=-565.8kJ·mol-1
C.在反应C(s)+O2(g)=CO2(g)中,反应物的总键能大于生成物的总键能
D.由碳转化为一氧化碳的热化学方程式为:2C(s)+O2(g)=2CO(g)△H=-221.2kJ·mol-1
【答案】C
【解析】
由能量关系示意图可知,1molC+1molO2释放393.5kJ热量后得到1molCO2,1molCO+0.5molO2释放282.9kJ热量后得到1molCO2,以此写出热化学方程式;燃烧热是在25℃、101kPa时,1mol纯物质完全燃烧生成稳定的氧化物时所放出的热量;△H=反应物的总键能-生成物的总键能,以此判断。
A. 由转化I可知,25℃时,碳的标准燃烧热:△H=-393.5kJ·mol-1,故A正确;
B. 转化II的热化学方程式为:2CO(g)+O2(g)=2CO2(g)△H=-565.8kJ·mol-1,故B正确;
C. 由转化I可知,反应C(s)+O2(g)=CO2(g) △H<0,则反应物的总键能小于生成物的总键能,故C错误;
D. 由能量关系示意图可得①![]() ,②
,②![]() ,由盖斯定律可知(①-②)×2可得热化学方程式为:
,由盖斯定律可知(①-②)×2可得热化学方程式为:![]() ,故D正确;
,故D正确;
故答案选:C。

 阳光试卷单元测试卷系列答案
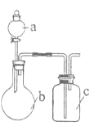
阳光试卷单元测试卷系列答案【题目】利用如图实验装置进行相关实验,能得出相应实验结论的是( )
a | b | c | 实验结论 |
| |
A | 浓醋酸 | CaCO3 | C6H5ONa溶液 | 酸性:碳酸>苯酚 | |
B | Br2的苯溶液 | 铁屑 | AgNO3溶液 | 苯和液溴发生取代反应 | |
C | 浓盐酸 | 酸性KMnO4溶液 | 碘化钾溶液 | 氧化性:Cl2>I2 | |
D | 饱和食盐水 | 电石 | 酸性KMnO4溶液 | 乙炔具有还原性 |
A.AB.BC.CD.D