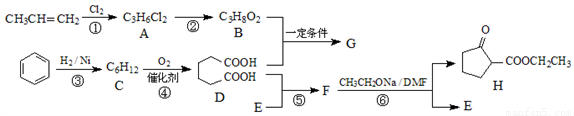
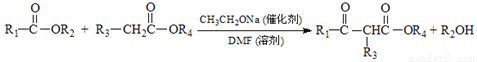
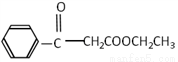
题目内容
CuCl广泛应用于化工和印染等行业。某研究性学习小组拟热分解CuCl2·2H2O制备CuCl,并验证其它分解产物。
【查阅资料】
①
②CuCl是一种白色难溶固体,潮湿CuCl在空气中缓慢被氧化
⑴配平潮湿CuCl在空气中被氧化的化学方程式_________
____CuCl+_____O2+_____□=_______3CuO·CuCl2·3H2O+______HCl
【实验探究】该小组选用下图装置进行实验(夹持加热仪器略)。
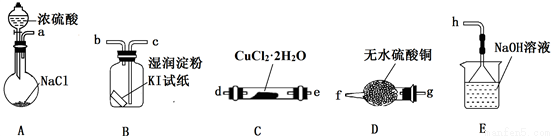
⑵装置A用于制取HCl:NaCl+H2SO4=NaHSO4+HCl↑,浓硫酸在该反应中体现强酸性和_________性;
⑶按实验要求选择上图装置,连接顺序为:a_______(按气流方向,用小写字母表示);
⑷根据完整的实验装置进行实验,实验步骤如下:
①连接装置,_______;②装入药品;③打开分液漏斗活塞;④控制温度加热硬质玻璃管一段时间;⑤停止通HCl,升温继续加热;…
步骤①是__________________;步骤④通HCl的目的是_________________;
⑸装置E中发生反应的离子方程式是______________________。
【实验分析与改进】
⑹装置B中试纸先变蓝后又褪色,经查资料获知过量的Cl2能将I2氧化。甲同学认为可将湿润的淀粉KI试纸改成足量的淀粉KI溶液以克服Cl2过量的问题,但小组分析后认为该方案存在一个明显安全问题:_____________________
⑺反应结束后,CuCl产品中可能含有少量未分解的CuCl2,乙同学认为只用一种日常生活常见的液体即可检验。该实验方案为:取少量固体放入小试管中,_________________。
某学习小组利用反应:5H2C2O4+2KMnO4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O H2C2O4来探究“外界条件对化学反应速率的影响”。实验时,先分别量取KMnO4酸性溶液、H2C2O4溶液,然后倒入大试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。
(1)该反应是溶液之间发生的不可逆反应,改变压强对其反应速率的影响是______(填序号)。
A.可能明显加快 B.可能明显减慢 C.几乎无影响,可以忽略
(2)甲同学设计了如下实验
实验编号 | H2C2O4溶液 | KMnO4溶液 | 温度/℃ | ||
浓度(mol/L) | 体积(mL) | 浓度(mol/L) | 体积(mL) | ||
a | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
B | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
c | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
①探究温度对化学反应速率影响的组合实验编号是__________,可探究温度对化学反应速率影响的实验编号是__________。
②实验a测得混合后溶液褪色的时间为40%,忽略混合前后 体积的微小变化,则这段时间内的平均反应速率v(KMnO4)=______。
(3)在其它条件相同的情况下,乙同学用不同浓度的KMnO4酸性溶液实验,测得实验数据如下表所示:
实验编号 | 温度℃ | H2C2O4溶液 | KMnO4酸性溶液 | 褪色的时间(min) | |||
浓度(mol/L) | 体积(mL) | 浓度(mol/L) | 体积(mL) | ||||
1 | 25 | 0.10 | 4 | 0.2 | 8 | t1 | |
2 | 25 | 0.010 | 4 | 0.2 | 8 | t2(t2<t3) | |
依据表中数据,_____(填“能”或“不能”)得出“溶液褪色所需时间越短,反应速率越快”的结论,理由是__________________。
(4)在实验中,草酸(H2C2O4)溶液与KMnO4酸性溶液反应时,褪色总是先慢后快。
①同学们据此提出以下假设:
假设1:该反应为放热反应
假设2:反应生成的Mn2+对该反应有催化作用
假设3:反应生成的K+或SO42-该反应有催化作用
丙同学认为假设3不合理,其理由是__________。
②丁同学用如下实验证明假设2成立:在A和B两支试管中分别加入4mL0.2mol·L-1草酸溶液,再在A试管中加入lmL0.1mol·L-1MnSO4溶液、B试管中加入1mL蒸馏水,然后在两支试管中同时分别加入1mLO.1mol·L-1KMnO4酸性溶液,A试管溶液褪色的时间明显早于B试管。在B试管中加入1mL蒸馏水的目的是:__。
③同学们认为不宜用MnCl2溶液代替MnSO4溶液对该反应进行催化探究,其原因是(用离子方程式表示)_______________。


 _______________________
_______________________ _____________________
_____________________