题目内容
某兴趣小组设计并进行了以下实验来探究Cl2、漂白粉的制备及有关性质。
(1)实验室拟用下列装置制备干燥纯净的氯气,请按照气体从左向右流动的方向将仪器进行连接:
H→ 、 → 、 → ;广口瓶Ⅱ中的试剂为 。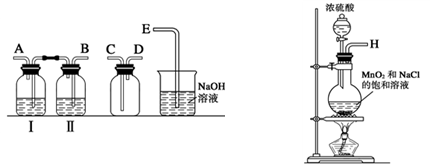
(2)写出工业上用氯气和石灰乳制取漂白粉的化学反应方程式:
;
某学生设计如下实验进一步探究SO2与漂粉精的反应:
| 操作 | 现象 |
| 取4 g漂粉精固体,加入100 mL水 | 部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的pH | pH试纸先变蓝(约为12),后褪色 |
 A | ⅰ.液面上方出现雾状物 ⅱ.稍后,出现浑浊,溶液变为黄绿色 ⅲ.稍后,产生大量白色沉淀,黄绿色褪去 |
(3)pH试纸颜色的变化说明漂粉精溶液具有的性质是 。
(4)该同学推测现象i的雾状物由盐酸小液滴形成,进行如下实验加以进一步验证:
a.用湿润的碘化钾淀粉试纸检验雾状物,无变化;
b.搜集雾状物,用酸化的AgNO3溶液检验,产生白色沉淀。
实验a的目的是 。
(5)现象ⅱ中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的某些成份之间发生反应。请设计实验方案,进一步确认这种可能性,方案为
。
(6)用化学方程式解释现象ⅲ中黄绿色褪去的原因: 。检验褪色后溶液中是否有
 的方法是: 。
的方法是: 。
(1)BACDE (1分);饱和食盐水(1分)
(2)2Ca(OH)2 +2 Cl2 →Ca(ClO)2 +CaCl2 +2H2O (2分)
(3)碱性、漂白性 (2分)
(4)排除氯气干扰(1分,合理给分)
(5)向漂粉精溶液中逐滴加入硫酸,观察溶液是否变为黄绿色(1分,合理给分)
(6)SO2 +Cl2 +2H2O → H2SO4 +2HCl (2分);取样,加入足量的硝酸钡,带沉淀沉积后,取上层清夜,滴入硝酸银与稀硝酸,产生白色沉淀,说明有Cl—。(2分)
解析试题分析:(1)制备氯气的实验中,要除去杂质氯化氢和水蒸汽,所以用到洗气装置,一般是长进短出,因此顺序为:B A C D E,又因为是先除去混合气中的氯化氢,因此广口瓶Ⅱ中的试剂为饱和食盐水,(氯气在饱和食盐水的溶解度较小)。
(2)写出工业上用氯气和石灰乳制取漂白粉的化学反应方程式:2Ca(OH)2 +2 Cl2 →Ca(ClO)2 +CaCl2 +2H2O 。
(3)pH试纸颜色先变蓝说明呈碱性,后褪色说明漂粉精有漂白性。
(4)该同学推测现象i的雾状物由盐酸小液滴形成,进行如下实验加以进一步验证:a.用湿润的碘化钾淀粉试纸检验雾状物,无变化目的是排除氯气干扰。
(5)现象ⅱ中溶液变为黄绿色说明有氯气生成,实质是次氯酸根,氯离子在酸性溶液中发生了反应。只要采用不含氯离子的溶液可以进行验证即可,方案为向漂粉精溶液中逐滴加入硫酸,观察溶液是否变为黄绿色。
(6)ⅲ中黄绿色褪去的原是二氧化硫具有还原性和氯气发生氧化还原反应,SO2 +Cl2 +2H2O → H2SO4 +2HCl。检验褪色后溶液中是否有氯离子的方法是取样,加入足量的硝酸钡,带沉淀沉积后,取上层清夜,滴入硝酸银与稀硝酸,产生白色沉淀,说明有Cl—。
考点:Cl2、漂白粉的制备及有关性质。

 全优点练单元计划系列答案
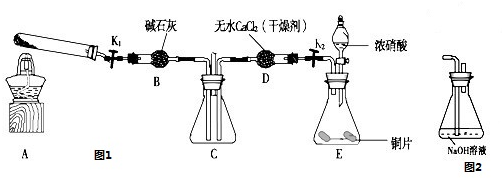
全优点练单元计划系列答案为了探究AgNO3的氧化性和热稳定性,某化学兴趣小组设计了如下实验。
Ⅰ.AgNO3的氧化性
将光亮的铁丝伸入AgNO3溶液中,一段时间后将铁丝取出。为检验溶液中Fe的氧化产物,将溶液中的Ag+除尽后,进行了如下实验,可选用试剂:KSCN溶液、K3[Fe(CN)6]溶液、氯水。
(1)请完成下表:
| 操作 | 现象 | 结论 |
| 取少量除尽Ag+后的溶液于试管中,加入KSCN溶液,振荡 | | 存在Fe3+ |
| 取少量除尽Ag+后的溶液于试管中,加入________,振荡 | | 存在Fe2+ |
【实验结论】 Fe的氧化产物为Fe2+和Fe3+。
Ⅱ.AgNO3的热稳定性
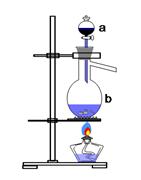
用下图所示的实验装置A加热AgNO3固体,产生红棕色气体,在装置D中收集到无色气体。当反应结束后,试管中残留固体为黑色。

(2)装置B的作用是________。
(3)经小组讨论并验证该无色气体为O2,其验证方法是________。
(4)【查阅资料】 Ag2O和粉末状的Ag均为黑色;Ag2O可溶于氨水。
【提出设想】试管中残留的黑色固体可能是:ⅰ.Ag;ⅱ.Ag2O;ⅲ.Ag和Ag2O。
【实验验证】该小组为验证上述设想,分别取少量黑色固体放入试管中,进行了如下实验。
| 实验编号 | 操作 | 现象 |
| a | 加入足量氨水,振荡 | 黑色固体不溶解 |
| b | 加入足量稀硝酸,振荡 | 黑色固体溶解,并有气体产生 |
【实验评价】根据上述实验,不能确定固体产物成分的实验是________(填实验编号)。
【实验结论】根据上述实验结果,该小组得出AgNO3固体热分解的产物有________。
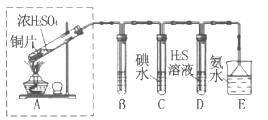
某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如下图所示的实验装置(支撑用的铁架台省略),按要求回答问题。
(1)下列方法中,可制得氯气的正确组合是 。
①MnO2和浓盐酸混合共热
②KMnO4和浓盐酸混合 ③氯酸钠和浓盐酸混合 ④K2Cr2O7和浓盐酸混合
| A.①②③ | B.①②④ | C.①② | D.全部可以 |
(3)①装置B的作用是 ,现象是 。
②装置C和D出现的不同现象说明的问题是 。
③装置E的作用是
目前我国饮用水消毒主要用氯——通氯气,加漂白粉或漂白精。
(1) 漂白粉或漂白精长期放置于空气中会变质失效,其化学方程式是__________________。
(2)目前我国广泛采用经过干燥空气稀释的氯气,通入填有固体亚氯酸钠(NaClO2)的柱内
制得ClO2,这一反应的化学方程式是:_________________________________________。

 2KNO2↑+O2↑
2KNO2↑+O2↑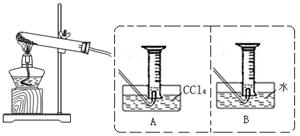
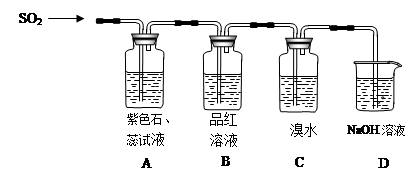
 8SO2+2Fe2O3该反应中被氧化的元素是_______(填元素符号)。当该反应转移2. 75mol电子时,生成的二氧化硫在标准状况下的体积为_______L。
8SO2+2Fe2O3该反应中被氧化的元素是_______(填元素符号)。当该反应转移2. 75mol电子时,生成的二氧化硫在标准状况下的体积为_______L。
 2CuO,CuO+H2SO4=CuSO4+H2O。
2CuO,CuO+H2SO4=CuSO4+H2O。