题目内容
(1)以硫酸工业的尾气、氨水、石灰石、焦炭及碳酸氢铵和KCl为原料可以合 成有重要应用价值的硫化钙、硫酸钾、亚硫酸氢铵等物质.合成路线如下:
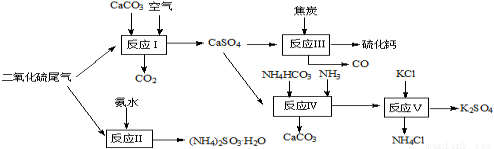
① 生产过程中,反应Ⅰ中需鼓入足量空气,试写出该反应的总方程式 。
② 反应Ⅱ中需要向溶液中加入适量的对苯二酚等物质(已知对苯二酚具有很强的还原性),其作用可能是 。
③ 反应Ⅲ中氧化剂与还原剂的物质的量之比为 。
④ 能用于测定尾气中SO2含量的是 。
A.滴有酚酞的NaOH溶液 B.酸性KMnO4
C.滴有淀粉的碘水 D.BaCl2溶液.
(2)已知铅蓄电池放电时发生如下反应:
负极:Pb-2e-+SO42-=PbSO4 正极:PbO2+4H++SO42-+2e-=PbSO4+2H2O
如果用铅蓄电池做电源电解饱和食盐水制取Cl2,已知某铅蓄电池中硫酸溶液的体积为0.80L,电解前硫酸溶液浓度为4.50mol.L-1,当制得29.12 L Cl2时(指在标准状况下),求理论上电解后电池中硫酸溶液的浓度为(假设电解前后硫酸溶液的体积不变)________ mol.L-1。
(1)①2CaCO3+2SO2+O2=2CaSO4+2CO2
②防止亚硫酸铵被氧化 ③1:4 ④ BC
(2)(1.25)
【解析】
试题分析:(1)①反应Ⅰ中鼓入足量空气,使SO2与CaCO3 、O2充分反应,方程式为2CaCO3+2SO2+O2=2CaSO4+2CO2
②亚硫酸盐在空气中易被氧气氧化,所以加入适量的对苯二酚等物质的目的是防止亚硫酸铵被氧化
③反应Ⅲ为4C+ CaSO4=CaS+4CO↑,氧化剂是CaSO4,还原剂是C,所以氧化剂与还原剂物质的量比是1:4
④A、D与SO2反应可能生成硫酸盐或亚硫酸盐,无法确定含量,B、C均可与SO2发生氧化还原反应,可计算SO2含量,答案选B、C。
(2)当制得29.12 L Cl2时(指在标准状况下),转移电子29.12L/22.4L/mol×2=5.2mol,则在铅蓄电池中转移电子也为5.2mol,消耗硫酸2.6mol,原有硫酸0.80L×4.50mol.L-1=3.6mol,余硫酸3.6mol-2.6mol=1mol,所以理论上电解后的硫酸浓度为1mol/0.8L=1.25 mol.L-1
考点:考查物质的合成、分析,电解原理的应用