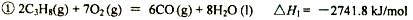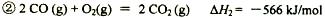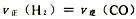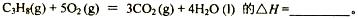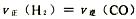题目内容
用惰性电极电解一定质量的某浓度的NaCl溶液,一段时间后停止电解.此时若加入100g36.5%的浓盐酸,所得溶液正好与原溶液完全相同,则下列说法正确的是( )
| A.电解过程中,两极所得到的气体,在相同的条件下体积相等 |
| B.电解过程中,在相同的条件下,阳极所得到的气体的体积比阴极的大 |
| C.电解过程中转移电子的物质的量约为8mol |
| D.原某浓度的NaCl溶液中溶有117gNaCl |
A、如果纯粹电解NaCl,那么应该补充纯粹的HCl气体即可,而现在加入的是100g36.5%的浓盐酸,其中含HCl为
=1mol,相当于电解HCl即2HCl
H2↑+Cl2↑,
含水为
=3.5mol,由此知还应该有水的电解,即2H2O
2H2+O2,
根据反应:2HCl
H2↑+Cl2↑,
2 1 1
1mol 0.5mol 0.5mol
2H2O
2H2+O2
2 2 1
3.5mol 3.5mol 1.75mol
阳极生成的气体为:0.5+1.75=2.25mol;阴极产生的气体为:0.5+3.5=4mol,两极产生的气体体积不相等,故A错误;
B、阴极产生的是H2,物质的量为4mol,阳极产生的是Cl2和O2,物质的量为2.25mol,阴极所得的气体体积比阳极多,故B错误;
C、1molCl转移1mol电子,1molH2O转移2mol电子,转移电子的总数是1×1+3.5×2=8mol,故C正确;
D、原某浓度的NaCl溶液中溶有1mol的Cl-离子,则NaCl的物质的量也是1mol,可得原某浓度的NaCl溶液中溶有(23+35.5)×1=58.5gNaCl,故D错误;
故选C.
| 100×36.5%g |
| 36.5g/mol |
| ||
含水为
| 100×63.5%g |
| 18g/mol |
| ||
根据反应:2HCl
| ||
2 1 1
1mol 0.5mol 0.5mol
2H2O
| ||
2 2 1
3.5mol 3.5mol 1.75mol
阳极生成的气体为:0.5+1.75=2.25mol;阴极产生的气体为:0.5+3.5=4mol,两极产生的气体体积不相等,故A错误;
B、阴极产生的是H2,物质的量为4mol,阳极产生的是Cl2和O2,物质的量为2.25mol,阴极所得的气体体积比阳极多,故B错误;
C、1molCl转移1mol电子,1molH2O转移2mol电子,转移电子的总数是1×1+3.5×2=8mol,故C正确;
D、原某浓度的NaCl溶液中溶有1mol的Cl-离子,则NaCl的物质的量也是1mol,可得原某浓度的NaCl溶液中溶有(23+35.5)×1=58.5gNaCl,故D错误;
故选C.

练习册系列答案
 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案
相关题目