题目内容
【题目】A.
光解水的催化材料可用硝酸镍、硫脲和锐钛矿为原料,采用醇热法制得。
(1)Ni2+基态核外电子排布式为__________________。
(2)与NO3-互为等电子体的一种分子的化学式为__________________。
(3)硫脲(![]() )中C原子轨道的杂化类型为__________________;
)中C原子轨道的杂化类型为__________________;
1 mol硫脲中含有键的数目为____________mol。
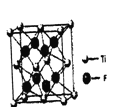
钛的一种氟化物晶胞结构如右图所示,其化学式为____________。
(5)甘油(丙三醇)具有保持水分的功效,其主要原因是____________。
【答案】 1s22s22p63s23p63d8(或[Ar]3d8) SO3(或BF3等) sp2 7 TiF2 与水分子间形成氢键
【解析】(1)镍原子核外电子数是28,镍原子失去最外层2个电子变成基态Ni2+,根据构造原理知,基态Ni2+的核外电子排布式为1s22s22p63s23p63d8(或[Ar]3d8),故答案为:1s22s22p63s23p63d8(或[Ar]3d8)
(2)等电子体要求原子数要相同,最外层电子(价电子)总数要相同,NO3-共4个原子,最外层电子总数为24,按照同主族最外层电子书数相同,符合要求的有SO3(或 BF3等)。
(3)![]() 中碳原子形成三个共价键,键角为120°,形成一个平面三角形结构,故碳为sp2 杂化;一个单键为一个σ键,有4个N-H键和2个C-N键,一个双键中含一个σ键,所以共有7个σ键。
中碳原子形成三个共价键,键角为120°,形成一个平面三角形结构,故碳为sp2 杂化;一个单键为一个σ键,有4个N-H键和2个C-N键,一个双键中含一个σ键,所以共有7个σ键。
(4)一个晶胞中Ti原子个数为8×1/8+6×1/2=4,F原子个数为8,两者原子个数比为1∶2,化学式为TiF2
(5)丙三醇分子的-OH上的O原子电负性大,能与水分子中的H原子形成氢键,同样水分子中的O原子也能与丙三醇—OH上的H形成氢键,且丙三醇含有较多的-OH ,氢键作用力较大,导致丙三醇能与水互溶,具有较好的保持水分的功效,答案为:与水分子间可形成氢键

【题目】某合金与铁的物理性质的比较如表所示( )
项目 | 熔点/°C | 密度/ | 硬度(金刚 | 导电性 |
某合金 | 2 500 | 3.00 | 7.4 | 2.3 |
铁 | 1 535 | 7.86 | 4.5 | 17 |
从性能看,该合金不适合制( )
A.导线
B.门窗框
C.炉具
D.飞机外壳


