题目内容
15.某学生按一定的顺序向一支试管中加入下列几种物质(一种物质只加一次):A.KI溶液 B.淀粉溶液 C.NaOH溶液 D.稀H2S04 E.氯水
发现溶液颜色按如下顺序变化:①KI溶液无色→②棕黄→③蓝色→④无色→⑤蓝色.已知③→④加NaOH溶液,依据溶液颜色的变化,回答下列问题:
(1)加入以上药品的顺序是(写序号)A→E→B→C→D
(2)①→②反应的化学方程式为Cl2+2KI=2KCl+I2
(3)溶液由棕黄色变为蓝色的原因是碘与淀粉变蓝色
(4)③→④反应的化学方程式为I2+2NaOH═NaI+NaIO+H2O.
分析 KI为无色溶液,加入氯水反应生成碘,变为棕黄色,然后加淀粉变蓝,再加NaOH反应生成NaI、NaIO,溶液又变为无色,最后加硫酸,发生氧化还原反应生成单质碘,溶液中还有淀粉,则变蓝,以此来解答.
解答 解:KI为无色溶液,加入氯水反应生成碘,变为棕黄色,然后加淀粉变蓝,再加NaOH反应生成NaI、NaIO,溶液又变为无色,最后加硫酸,发生氧化还原反应生成单质碘,溶液中还有淀粉,则变蓝,
(1)由上述分析可知,加入以上药品的顺序是AEBCD,故答案为:E;B;D;
(2)①→②反应的化学方程式为Cl2+2KI═2KCl+I2,故答案为:Cl2+2KI═2KCl+I2;
(3)碘单质遇淀粉变蓝,则溶液由棕黄色变为蓝色,故答案为:碘单质遇淀粉变蓝;
(4)③→④反应的化学方程式为I2+2NaOH═NaI+NaIO+H2O,故答案为:I2+2NaOH═NaI+NaIO+H2O.
点评 本题考查氯、溴、碘及其化合物之间的转化,为高频考点,明确发生的化学反应是解答本题的关键,注意反应与现象的关系,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
5.X、Y和Z是短周期元素组成的三种单质,X的组成元素是第三周期原子半径最大的元素;Y和Z均由元素R组成,Y由两个原子组成,R最外层电子数是内层电子数的3倍,下列推断正确的是( )
| A. | Y和Z互为同位素 | |
| B. | X和Y能化合成两种化合物 | |
| C. | X和Y化合的产物中一定不含有共价键 | |
| D. | X离子比R的离子半径大 |
10.常温下,下列各组离子或分子在指定溶液中一定能大量共存的是( )
| A. | 加入KSCN变红的溶液中:Na+、Al3+、Cl-、S2- | |
| B. | 1.0 mol?L-1的Na2CO3的溶液中:NH4+、SO32-、Cl-、SO2 | |
| C. | 能使甲基橙变红的溶液中:Cu2+、Mg2+、SO42-、Cl- | |
| D. | 葡萄糖溶液中:Na+、H+、SO42-、Cr2O72- |
20.某炔烃与足量的H2加成后的产物是 ,则原来的炔烃可能是( )
,则原来的炔烃可能是( )
 ,则原来的炔烃可能是( )
,则原来的炔烃可能是( )| A. | 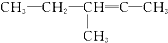 | B. |  | ||
| C. | 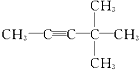 | D. | 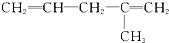 |
7.某元素最高价氧化物对应水化物的化学式是H2RO4,这种元素的气态氢化物的化学式为( )
| A. | HR | B. | H2R | C. | RH3 | D. | RH4 |
4.用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 标准状况下,22.4L H2含有的原子数为NA | |
| B. | 等质量的O2和O3中所含的氧原子数相等 | |
| C. | 同温同压下,相同体积的H2和O2,其质量比为1:16 | |
| D. | 28g CO与22.4L CO2所含的碳原子数相等 |

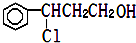 $\stackrel{②}{→}$X$→_{③△}^{NaOH乙醇溶液}$乙
$\stackrel{②}{→}$X$→_{③△}^{NaOH乙醇溶液}$乙 .
.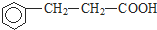 ).写出同时符合下列要求的丙的同分异构体结构简式
).写出同时符合下列要求的丙的同分异构体结构简式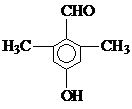 、
、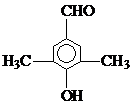 .
.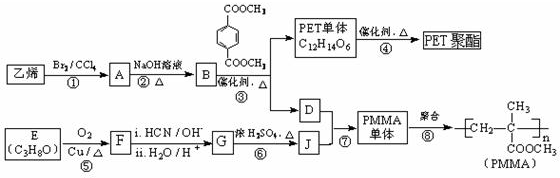
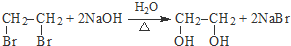 .
.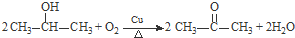 .
.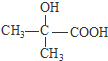 .
. 与足量NaOH溶液反应时,最多消耗4mol NaOH
与足量NaOH溶液反应时,最多消耗4mol NaOH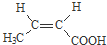 .
. .
.