题目内容
某有机物的相对分子质量为46,为测定其结构,做如下实验:(1)将2.3g该有机物完全燃烧,生成0.1molCO2和2.7g水;(2)用核磁共振仪处理该化合物,得到谱图中有三个吸收峰,且三个峰的面积之比是1:2:3,确定该有机物的分子式及结构简式。
C2H6O;CH3CH2OH
试题分析:2.7g水的物质的量是2.7g÷18g/mol=0.15mol
其中氢原子的质量是0.15mol×2×1g/mol=0.3g
氢原子的物质的量是0.3mol
0.1molCO2中碳原子的质量是0.1mol×12g/mol=1.2g
所以2.3g有机物质氧原子的质量是2.3g-0.3g-1.2g=0.8g
氧原子的物质的量是0.8g÷16g/mol=0.05mol
所以有机物中碳、氢、氧原子的个数之比是2:6:1
由于氢原子已经饱和
所以该有机物的分子式是C2H6O
又因为得到谱图中有三个吸收峰,且三个峰的面积之比是1:2:3
所以该有机物的结构简式是CH3CH2OH
点评:该题是中等难度的试题,试题综合性强,注重考查学生分析问题、以及灵活运用基础知识解决实际问题的能力。该题的关键是根据质量守恒定律得出有机物中含有氧元素,然后依据题意灵活运用计算、判断即可得出正确的结论。

练习册系列答案
相关题目
 键断裂
键断裂
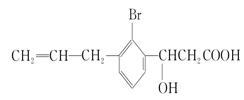 ,则此有机物可发生反应的类型有( )
,则此有机物可发生反应的类型有( )