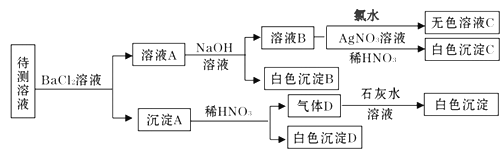
题目内容
【题目】常温时,向0.1moLH2S溶液中通入HCl气体或加入NaOH固体,测得c(S2-)与溶液pH的关系如图(忽略溶液体积的变化及H2S的挥发)。已知常温下,H2S在水中的电离常数Ka1=1.3×10-7,Ka2=7.0×10-15。下列说法错误的是

A. 当溶液中c(S2-)=1.4×10-19mol/L时,溶液中由水电离出的H+浓度为1.0×10-13mo/L
B. 0.1mo/LNa2S溶液中离子浓度之间的关系为:c(Na+)>c(HS-)+2c(S2-)
C. 常温下,0.1 mol/L NaHS溶液的pH<7
D. 当pH=13时,溶液中的c(H2S)+c(HS-)=0.043mo/L
【答案】C
【解析】
A.由图知当溶液中c(S2-)=1.4×10-19mol/L时,溶液pH=1,即c(H+)=1×10-1mol/L时,则常温下由水电离的c水(H+)=c水(OH-)=Kw/ c(H+)=1.0×10-13mo/L,故A正确;
B.Na2S溶液中由电荷守恒有c(H+) + c(Na+)=c(HS-) + 2c(S2-) + c(OH-),溶液为强碱弱酸盐显碱性,即c(OH-)>c(H+),则c(Na+)>c(HS-)+2c(S2-),故B正确;
C.HS-既会电离也会水解,由Ka1知其水解常数Kb= Kw/ Ka1=7.7×10-8> Ka2,即HS-水解程度大于电离程度,溶液应显碱性pH>7,故C错误;
D.pH=13时,c(S2-)=5.7×10-2mol/L,在0.10molL-1H2S溶液中根据硫守恒c(H2S)+c(HS-)+c(S2-)=0.10molL-1,所以c(H2S)+c(HS-)=0.1-5.7×10-2=0.043mol/L,故D正确。
本题选C。

 金博士一点全通系列答案
金博士一点全通系列答案