题目内容
3.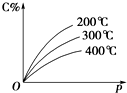 可逆反应mA(s)+nB(g)?eC(g)+fD(g),反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(p)的关系如图所示,下列叙述中正确的是( )
可逆反应mA(s)+nB(g)?eC(g)+fD(g),反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(p)的关系如图所示,下列叙述中正确的是( )| A. | 达到平衡后,若升高温度,平衡右移 | |
| B. | 达到平衡后,加入催化剂C%增大 | |
| C. | 化学方程式中“n>e+f” | |
| D. | 达到平衡后,增加A的量有利于平衡向右移动 |
分析 根据图象知,升高温度,C的含量减小,则该反应的正反应是放热反应,增大压强,C的含量增大,则平衡向正反应方向移动,所以该反应是一个气体体积减小的可逆反应,据此回答.
解答 解:A.该反应的正反应是放热反应,达到平衡后,若升温,平衡左移,故A错误;
B.达到平衡后,加入催化剂不会影响化学平衡的移动,C的百分含量不变,故B错误;
C.压强增大,C%含量增大,说明平衡正向进行,正反应是气体体积减小的反应,n>e+f,故C正确;
D.达到平衡后,A是固体,不影响平衡移动,所以增加A的量平衡不移动,故D错误;
故选:C.
点评 本题考查化学平衡的影响因素分析判断,图象分析方法,注意催化剂的作用,固体改变量平衡不动,题目难度中等.

练习册系列答案
 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案
相关题目
13.二氧化碳捕捉与封存技术是实现室温气体减排的重要途径之一,科学家利用NaOH溶液喷淋“捕捉”空气中的二氧化碳.
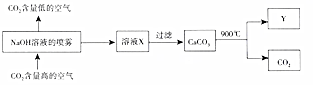
(1)二氧化碳的电子式是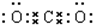 .
.
(2)NaOH溶液喷成雾状的目的是增大气液反应物的接触面积,加快反应速率,提高二氧化碳的吸收率.
(3)若使用800mL1.0mol/LNaOH溶液吸收11.2L(标准状况)的CO2.
①反应的离子方程式是5CO2+8OH-=3CO32-+2HCO3-+3H2O.
②用所得溶液中的n(CO32-)、n(H2CO3)、n(H+)、n(OH-)这四个物理量建立一个代数式,使其值为0.3mol,即n(CO32-)-n(H2CO3)-n(H+)+n(OH-)等于0.3mol.
(4)该流程中可循环利用的物质有CaO、NaOH.
(5)某学习小组对碳酸钠和碳酸氢钠溶液进行了实验研究:
①步骤 I中,碳酸钠溶液的颜色较深,理由是碳酸根离子的水解程度大于碳酸氢根离子.
②加热碳酸钠溶液,红色变深的原因是升高温度,促进碳酸根离子的水解.
③加热碳酸氢钠溶液,溶液颜色也加深,除与碳酸钠相似的原因外,还可能有的原因是2NaHCO3$\frac{\underline{\;加热\;}}{\;}$Na2CO3+H2O+CO2↑(用化学方程式表示).

(1)二氧化碳的电子式是
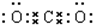 .
.(2)NaOH溶液喷成雾状的目的是增大气液反应物的接触面积,加快反应速率,提高二氧化碳的吸收率.
(3)若使用800mL1.0mol/LNaOH溶液吸收11.2L(标准状况)的CO2.
①反应的离子方程式是5CO2+8OH-=3CO32-+2HCO3-+3H2O.
②用所得溶液中的n(CO32-)、n(H2CO3)、n(H+)、n(OH-)这四个物理量建立一个代数式,使其值为0.3mol,即n(CO32-)-n(H2CO3)-n(H+)+n(OH-)等于0.3mol.
(4)该流程中可循环利用的物质有CaO、NaOH.
(5)某学习小组对碳酸钠和碳酸氢钠溶液进行了实验研究:
| 实验序号 | 实验操作 | 实验现象 |
| 步骤 I | 分别取等体积、等物质的量浓度的碳酸钠和碳酸氢铵溶液,滴加酚酞试液 | 两份溶液均变为红色 |
| 步骤 II | 加热两份溶液 | 溶液颜色均变深 |
| 步骤 III | 将上述两份溶液恢复到室温 | 碳酸钠溶液颜色恢复为原来的深浅;碳酸氢钠溶液的颜色也变浅,但比原先要深 |
②加热碳酸钠溶液,红色变深的原因是升高温度,促进碳酸根离子的水解.
③加热碳酸氢钠溶液,溶液颜色也加深,除与碳酸钠相似的原因外,还可能有的原因是2NaHCO3$\frac{\underline{\;加热\;}}{\;}$Na2CO3+H2O+CO2↑(用化学方程式表示).
14.NA表示阿伏伽德罗常数.下列叙述中正确的是( )
| A. | 标准状况下,22.4LCCl4中含CCl4分子数为NA | |
| B. | 4.0gNaOH固体溶于100 mL水中,得到1 mol/L的NaOH溶液 | |
| C. | 常温常压,5.6gFe在足量Cl2中燃烧,转移的电子数为0.3NA | |
| D. | 分子总数为NA的SO2和CO2的混合气体中含有的氧原子数为4NA |
11.恒温下,将16mol N2与24mol H2的混合气体通入一个固定容积为4L的密闭容器中,发生如下反应:N2(g)+3H2(g)?2NH3(g),10分钟后反应达平衡时,NH3的含量(体积分数)为25%,下列的关说法正确的是( )
| A. | 达到平衡时,N2和H2的转化率之比为1:1 | |
| B. | 10分钟内v(H2)=0.35mol/(L•min) | |
| C. | 平衡混合气体的密度为124g/L | |
| D. | 平衡混合气体中,n(N2):n(H2):n(NH3)=1:3:2 |
18. 1915年诺贝尔物理学奖授予Henry Bragg和Lawrence Bragg,以表彰他们用X射线对晶体结构的分析所作的贡献.
1915年诺贝尔物理学奖授予Henry Bragg和Lawrence Bragg,以表彰他们用X射线对晶体结构的分析所作的贡献.
(1)科学家通过X射线探明,NaCl、KCl、MgO、CaO晶体结构相似,其中三种晶体的晶格能数据如表:
四种晶体NaCl、KCl、MgO、CaO熔点由高到低的顺序是MgO>CaO>NaCl>KCl,Na、Mg、Al第一电离能I1从小到大的排列顺序是Na<Al<Mg.
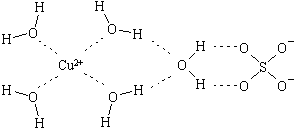
(2)科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如下,其中配位键和氢键均采用虚线表示.
①实验证明,用蒸汽密度法测得的H2O的相对分子质量比用化学式计算出来的相对分子质量要大,其原因是水分子间有氢键发生缔合作用.
②SO42-中S原子的杂化类型是sp3,与其互为等电子体的分子有CCl4(SiCl4)等(任写一种)
③Cu2+还能与NH3、Cl-等形成配位数为4的配合物,[Cu(NH3)4]2+中存在的化学键类型有AC(填序号)
A.配位键 B.离子键 C.极性共价键 D.非极性共价键
④写出基态Cu原子的外围电子排布式3d104s1;
金属铜采用面心立方堆积方式,已知Cu原子的半径为r pm,相对原子质量为M,NA表示阿伏加德罗常数,则金属铜的密度是$\frac{4M}{{{N_A}{{(2\sqrt{2}r×{{10}^{-10}})}^3}}}$g/cm3(列出计算式).
 1915年诺贝尔物理学奖授予Henry Bragg和Lawrence Bragg,以表彰他们用X射线对晶体结构的分析所作的贡献.
1915年诺贝尔物理学奖授予Henry Bragg和Lawrence Bragg,以表彰他们用X射线对晶体结构的分析所作的贡献.(1)科学家通过X射线探明,NaCl、KCl、MgO、CaO晶体结构相似,其中三种晶体的晶格能数据如表:
| 晶体 | NaCl | KCl | CaO |
| 晶格能/(kJ•mol-1) | 786 | 715 | 3401 |
(2)科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如下,其中配位键和氢键均采用虚线表示.
①实验证明,用蒸汽密度法测得的H2O的相对分子质量比用化学式计算出来的相对分子质量要大,其原因是水分子间有氢键发生缔合作用.
②SO42-中S原子的杂化类型是sp3,与其互为等电子体的分子有CCl4(SiCl4)等(任写一种)
③Cu2+还能与NH3、Cl-等形成配位数为4的配合物,[Cu(NH3)4]2+中存在的化学键类型有AC(填序号)
A.配位键 B.离子键 C.极性共价键 D.非极性共价键
④写出基态Cu原子的外围电子排布式3d104s1;
金属铜采用面心立方堆积方式,已知Cu原子的半径为r pm,相对原子质量为M,NA表示阿伏加德罗常数,则金属铜的密度是$\frac{4M}{{{N_A}{{(2\sqrt{2}r×{{10}^{-10}})}^3}}}$g/cm3(列出计算式).
8.网络神曲“化学是你,化学是我”揭示了化学与生活的密切关系.下列有关说法中正确的是( )
| A. | 青铜是我国使用最早的合金材料,目前世界上使用量最大的合金材料是铝合金 | |
| B. | 84消毒液在日常生活中使用广泛,溶液无色、有漂白作用,它的有效成分为Ca(ClO)2 | |
| C. | 碳酸钠俗名纯碱,也叫苏打,可用于清洗厨房用具的油污 | |
| D. | 明矾[KAl(SO4)2•12H2O]溶于水会形成胶体,因此可用于自来水的消毒杀菌 |
15.将E和F加入密闭容器中,在一定条件下发生反应:E(g)+F(s)?2G(g).忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如表所示:
①b<f ②915℃、2.0MPa时E的转化率为60%③该反应的△S>0 ④K(1000℃)<K(810℃)
上述①~④中正确的有( )
压强/MPa 体积分数/% 温度/℃ | 1.0 | 2.0 | 3.0 |
| 810 | 54.0 | a | b |
| 915 | c | 75.0 | d |
| 1000 | e | f | 83.0 |
上述①~④中正确的有( )
| A. | ① | B. | ②④ | C. | ①②③ | D. | ①②③④ |
 .
.