题目内容
 (2011?崇川区三模)在室温下,用0.10mol?L-1 KOH溶液滴定10.00mL 0.10mol?L-1H2C2O4(二元弱酸)溶液所得滴定曲线如图(混合溶液的体积可看成混合前两种溶液的体积之和).下列说法正确的是( )
(2011?崇川区三模)在室温下,用0.10mol?L-1 KOH溶液滴定10.00mL 0.10mol?L-1H2C2O4(二元弱酸)溶液所得滴定曲线如图(混合溶液的体积可看成混合前两种溶液的体积之和).下列说法正确的是( )分析:A.根据H2C2O4是二元弱酸,不能完全电离,c(H+)<0.10mol?L-1,再根据水的离子积常数可知c(OH-)>10-13mol?L-1;
B.点②、点⑤为混合溶液,遵循电荷守恒;
C.点③溶液显酸性,等体积等浓度反应生成KHC2O4,电离大于其水解;
D.根据物料守恒计算分析;
B.点②、点⑤为混合溶液,遵循电荷守恒;
C.点③溶液显酸性,等体积等浓度反应生成KHC2O4,电离大于其水解;
D.根据物料守恒计算分析;
解答:解:A.H2C2O4是二元弱酸,不能完全电离,c(H+)<0.10mol?L-1,再根据水的离子积常数可知c(OH-)>10-13mol?L-1,所以
<
=1012,故A错误;
B.点②、点⑤为混合溶液,由电荷守恒可知,c(K+)+c(H+)=c(HC2O4-)+2c(C2O42-)+c(OH-),故B错误;
C.点③溶液显酸性,等体积等浓度反应生成KHC2O4:KOH+H2C2O4═KHC2O4+H2O,HC2O4-电离大于其水解,则c(K+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-),故C错误;
D.点④为混合溶液,物料守恒得:c(K+)=
=0.06mol?L-1,c(H2C2O4)+c(HC2O4-)+c(C2O42-)=
=0.O4mol?L-1,所以c(K+)+c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.10mol?L-1,故D正确;
故选:D;
| c(H+) |
| c(OH-) |
| 0.10 |
| 10-13 |
B.点②、点⑤为混合溶液,由电荷守恒可知,c(K+)+c(H+)=c(HC2O4-)+2c(C2O42-)+c(OH-),故B错误;
C.点③溶液显酸性,等体积等浓度反应生成KHC2O4:KOH+H2C2O4═KHC2O4+H2O,HC2O4-电离大于其水解,则c(K+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-),故C错误;
D.点④为混合溶液,物料守恒得:c(K+)=
| 0.10mol?L-1×15mL |
| 25mL |
| 10mL ×0.10mol?L-1 |
| 25mL |
故选:D;
点评:本题考查酸碱混合溶液的定性判断及离子浓度的关系,注意草酸为弱酸,明确电荷守恒、物料守恒即可解答,题目难度中等.

练习册系列答案
相关题目
 (2011?崇川区三模)下列有关实验或操作的叙述正确的是( )
(2011?崇川区三模)下列有关实验或操作的叙述正确的是( )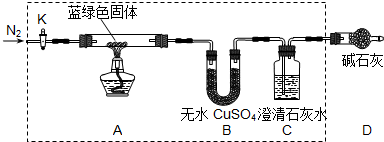


 +CH3OH
+CH3OH
 或
或
 或
或
