题目内容
【题目】甲溶液可能含有K+、Ca2+、NH4+、Cu2+、NO3-、Cl-、SO42-、CO32-八种离子中的若干种![]() 为确定甲溶液的组成,将其分成两等份,进行如下实验:
为确定甲溶液的组成,将其分成两等份,进行如下实验:
①向一份溶液中加入足量的NaOH浓溶液并加热,产生的气体在标准状况下体积为4.48L。
②向另一份溶液中加入0.6 mol/L的BaCl2溶液500mL,恰好可以与溶液中的离子完全反应,过滤得66.3g沉淀及滤液。
③向上述沉淀中加入过量的盐酸,产生的气体通入足量澄清的石灰水中,得到一定量的沉淀X。
④向上述滤液中加入1 mol/L AgNO3溶液650 mL,恰好可完全反应,据此,请回答下列问题![]() 用相应的离子符号表示
用相应的离子符号表示![]() :
:
⑴上述实验③中得到沉淀X的质量为______;生成沉淀X的离子方程式为______.
⑵甲溶液中一定不存在的离子是______;可能存在的离子是______.
⑶甲溶液一定存在的离子中,物质的量最大的离子是______;物质的量最小的离子是______,此物质的量最小的离子其物质的量为______。
【答案】10g ![]()
![]() 、
、![]()
![]()
![]()
![]()
![]()
【解析】
通过①得出铵根离子物质的量,
通过②分析得出碳酸根和硫酸根的物质的量,
通过③及离子共存分体得出不含的离子,
通过④分析含有的微粒及物质的量。
①向一份溶液中加入足量的NaOH浓溶液并加热,产生的气体在标准状况下体积为4.48L,应生成NH3,则一定含有NH4+,且![]() ;
;
②向另一份溶液中加入0.6 mol/L的BaCl2溶液500mL,恰好可以与溶液中的离子完全反应,过滤得66.3g沉淀及滤液,沉淀可能为BaSO4或BaCO3或二者都有,
如为BaSO4,则![]() ,
,
如为BaCO3,![]() ,
,
则说明甲中含有SO42-、CO32-,设分别为x mol、y mol,
则![]() ,x = 0.2 ,y = 0.1;
,x = 0.2 ,y = 0.1;
③向上述沉淀中加入过量的盐酸,产生的气体通入足量澄清的石灰水中,得到一定量的沉淀X,则说明含有CO32-,则一定不存在Ca2+、Cu2+;
④向上述滤液中加入1 mol/LAgNO3溶液650mL,恰好可完全反应,可知滤液中![]() ,而②加入
,而②加入![]() ,
,
则说明甲中含有Cl-,且![]() ,
,
如不含NO3-,则由电荷守恒可知一定含有K+,由![]() ,
,
则![]() ,
,
因分成两份,则甲含有0.4 mol NH4+、0.9 mol K+、0.4 mol SO42-、0.2 mol CO32-、0.1mol Cl-,如含有NO3-,则K+大于0.9 mol,
⑴上述实验③中得到沉淀X为碳酸钙,质量为0.1 mol × 100 g/mol=10g,生成沉淀X的离子方程式为Ca2+ + 2OH- + CO2== CaCO3↓ + H2O,
故答案为:10g;Ca2+ + 2OH- + CO2== CaCO3↓ + H2O;
⑵由以上分析可知一定不存在Ca2+、Cu2+,不能确定是否含有NO3-,
故答案为:Ca2+、Cu2+;NO3-;
⑶甲含有0.4 mol NH4+、0.9 mol K+、0.4 mol SO42-、0.2 mol CO32-、0.1mol C-,如含有NO3-,则K+大于0.9 mol,则物质的量最大的离子是K+;物质的量最小的离子是Cl-,此物质的量最小的离子其物质的量为0.1 mol,
故答案为:K+;Cl-;0.1 mol。

 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案【题目】氨气可有效消除NO2的污染,相关反应为8NH3+6NO27N2+12H2O,在1 L恒容密闭容器中,控制不同温度,分别加入0.50 mol NH3和1.2 mol NO2,测得n(NH3)随时间变化的有关实验数据如下表。
温度 n(NH3)/mol 时间/min | 0 | 10 | 20 | 40 | 50 |
T1 | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
T2 | 0.50 | 0.30 | 0.20 | … | 0.18 |
下列说法正确的是( )
A.T1温度下,0-20 min内,NO2的降解速率为0.0125 molL-1min-1
B.实验条件为T1<T2,且该反应为放热反应
C.40 min时,表格中T2对应的数据为0.20
D.0~10 min内,T1温度下NH3的降解速率大于T2温度下的
【题目】下列实验操作完全正确的是()
编号 | 实验 | 操作 |
A | 用浓硫酸配制一定浓度的稀硫酸 | 准确量取浓硫酸,将浓硫酸溶于水后,立刻转移到容量瓶中。 |
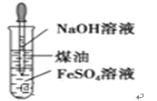
B | 制取氢氧化亚铁沉淀 |
|
C | 量取盐酸溶液 | 用50 mL量筒量取4.0 mol/L的盐酸5.62 mL |
D | 取出分液漏斗中所需的上层液体 | 下层液体从分液漏斗下端管口放出,关闭活塞,换一个接收容器,上层液体继续从分液漏斗下端管口放出 |
A.AB.BC.CD.D