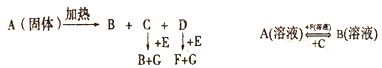��Ŀ����
����Ŀ��ijУ̽��ѧϰС�����Ѳ�������ķ���м����ӡˢ��·��ĸ�ʴ����������ͭ��̽��������ͼ��ʾ��

��ش��������⣺
��1����������ȼ����ȵ�Na2CO3��Һ�����ۣ�������������________��
��2��������У���������ӦFe��2HCl===FeCl2��H2���⣬�������ܷ�Ӧ�����ӷ���ʽΪ_______________________________________________________��
��3����ҺC����ɫ��________����ҺD�п��ܺ��еĽ�����������_______________��
��4��������֤��ҺB���Ƿ���Fe2����һ���Լ���______(��ѡ�����)��
a��ϡ���� b����c�����軯�� d�����Ը��������Һ
��5�������ҵ�������________������ݲ�������ͭ�Ļ�ѧ����ʽΪ_______________________________________________________________________��
���𰸡� ���� Fe2O3��6H��===2Fe3����3H2O��Fe��2Fe3��===3Fe2�� �ػ�ɫ d Fe2����Cu2����Fe3�� ��� CuCl2![]() Cu��Cl2��
Cu��Cl2��
����������1�������ȵ�̼������Һ��Ŀ����Ϊ�˳�ȥ��������ۣ��پ����˵õ����塣
��2��ʵ��ĵ����Ѿ���������ķ���м�����Ա��������������Ӧ�ô���������������ķ�Ӧ��
��3��ͨ�������Ժ���ҺCӦ�����Ȼ�����Һ����ɫΪ�ػ�ɫ�����Ȼ�����Һ��ʴӡˢ��·�壬��ӦΪCu���Ȼ�����Ӧ�������Ȼ�ͭ���Ȼ�������������Һ�п�����Fe2����Cu2����Fe3����
��4����֤�Ƿ���Fe2���ķ����ǵμ����Ը��������Һ��������ر�Fe2����ԭ����Һ����ɫ�����Դ�Ϊd��
��5����ҺD�����Ȼ������Ȼ�ͭ���Ȼ�������Ҫ��õ�����ͭ������Ӧ�ý��е�⣬���Ȼ�ͭ���Ϊ����ͭ�����������Է�Ӧ����ʽΪ��CuCl2![]() Cu��Cl2����
Cu��Cl2����

 �Ƹ�С״Ԫͬ������������ϵ�д�
�Ƹ�С״Ԫͬ������������ϵ�д�