题目内容
铁是地壳中含量很丰富的元素,也是生物体所必需的元素。金属铁是在高炉中冶炼的,在冶金工业中,常用焦炭来冶炼铁。
(1)写出焦炭在高炉中所参与反应的两个化学方程式:_____________________________ ____________________________________________________________________________。
(2)写出赤铁矿被CO还原成铁的化学方程式:_______________________。
(3)某高炉每天生产含铁96%的生铁70t,计算需用含20%杂质的赤铁矿 吨。
【答案】
C+O2  CO2 , C+CO2
CO2 , C+CO2 2CO ; 3CO+Fe2O3
2CO ; 3CO+Fe2O3 2Fe+3CO2 ,120
2Fe+3CO2 ,120
【解析】
试题分析:(1)高炉炼铁中的还原剂是CO,而CO是碳和CO2反应生成的,所以焦炭在高炉中所参与反应的两个化学方程式是C+O2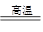 CO2 、C+CO2
CO2 、C+CO2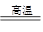 2CO。
2CO。
(2)赤铁矿被CO还原成铁的化学方程式是3CO+Fe2O3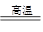 2Fe+3CO2 。
2Fe+3CO2 。
(3)设需用含20%杂质的赤铁矿的质量是x,则根据铁原子守恒可知 ,解得x=120t。
,解得x=120t。
考点:考查高炉炼铁的原理、方程式的书写以及化学计算等
点评:本题是常识性知识的考查,难度不大,不难得分。试题基础性强,主要是培养学生的规范答题能力,提高学生的应试能力。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
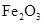 ,在加热
,在加热 ,在加热
,在加热