题目内容
【题目】有机物A由碳、氢、氧三种元素组成,为研究A的结构,进行了如下实验:称取17.2gA在足量的氧气中燃烧,产物经过足量的浓硫酸后,浓硫酸增重10.8g;再通过足量的碱石灰,碱石灰增重35.2g。质谱图表明A的相对分子质量为86,A可以使溴的四氯化碳溶液褪色,且A能与等物质的量的NaHCO3溶液恰好完全反应,请回答:
(1)A的分子式为________。
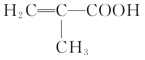
(2)若A分子具有支链,则A的结构简式为________;其与NaHCO3溶液反应的化学反应方程式为____________。
【答案】C4H6O2 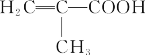
 +NaHCO3→
+NaHCO3→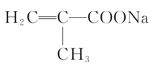 +H2O+CO2↑
+H2O+CO2↑
【解析】
(1) 浓硫酸增重10.8g,则m(H2O)= 10.8g,n(H2O)=![]() ,即n(H)=1.2mol ;
,即n(H)=1.2mol ;
再通过足量的碱石灰,碱石灰增重35.2g,则m(CO2)= 35.2g,n(CO2)= ![]() ,即n(C)=0.8mol;
,即n(C)=0.8mol;
有机物分子中含O原子的物质的量为:
n(O)=![]()
从而得出有机物的C:H:O=0.8mol:1.2mol:0.4mol=2:3:1
最简式为C2H3O
设分子式为(C2H3O)n,则43n=86,n=2。故分子式为C4H6O2
答案为C4H6O2
(2) A可以使溴的四氯化碳溶液褪色,则分子中含有碳碳不饱和键;A能与等物质的量的NaHCO3溶液恰好完全反应,说明分子内含有一个羧基-COOH,依据分子式中的碳、氢原子数关系,满足烯酸的组成,则分子中除含有一个羧基外,还含有一个碳碳双键。
若A分子具有支链,则A的结构简式为![]() 。答案为
。答案为![]()
其与NaHCO3溶液反应的化学反应方程式为
![]() +NaHCO3→
+NaHCO3→ +H2O+CO2↑
+H2O+CO2↑
答案为![]() +NaHCO3→
+NaHCO3→ +H2O+CO2↑
+H2O+CO2↑

【题目】氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
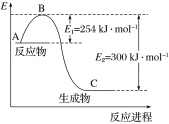
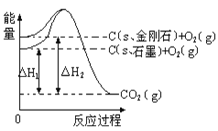
(1)上图是N2(g)和H2(g)反应生成1 mol NH3(g)过程中能量的变化示意图,请写出N2和H2反应的热化学方程式:______________。
(2)若已知下列数据:
化学键 | H—H | N≡N |
键能/kJ·mol-1 | 435 | 943 |
试根据表中及图中数据计算N—H的键能:________ kJ·mol-1。
(3)用NH3催化还原NOx还可以消除氮氧化物的污染。已知:
4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ΔH1=-a kJ·mol-1①
N2(g)+O2(g)===2NO(g) ΔH2=-b kJ·mol-1②
若1 mol NH3还原NO至N2,则该反应过程中的反应热ΔH3=________ kJ·mol-1(用含a、b的式子表示)。
(4)捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用。目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下可逆反应:
反应Ⅰ:2NH3(l)+H2O(l)+CO2(g) ![]() (NH4)2CO3(aq) ΔH1
(NH4)2CO3(aq) ΔH1
反应Ⅱ:NH3(l)+H2O(l)+CO2(g) ![]() NH4HCO3(aq) ΔH2
NH4HCO3(aq) ΔH2
反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g) ![]() 2NH4HCO3(aq) ΔH3
2NH4HCO3(aq) ΔH3
则ΔH3与ΔH1、ΔH2之间的关系是ΔH3=________。