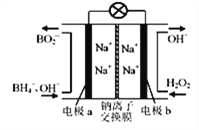
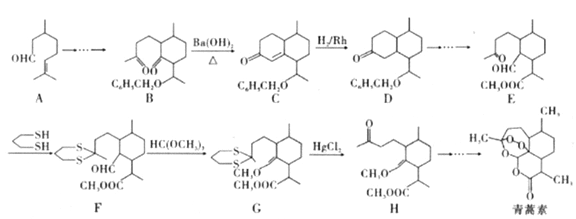
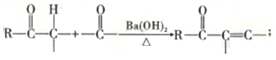
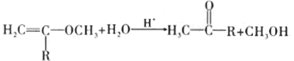
题目内容
【题目】下列事实不能用电化学理论解释的是 ( )
A. 轮船水线以下的船壳上装一定数量的锌块
B. 铝片不用特殊方法保存
C. 纯锌与稀硫酸反应时,滴入少量硫酸铜溶液后速率加快
D. 镀锌的铁比镀锡的铁耐用
【答案】B
【解析】试题分析:A是牺牲阳极的阴极保护法;B是由于在金属铝的表面有一层致密的氧化膜,能够阻止内部金属的腐蚀,和电化学原理无关系;C中可以构成原电池而加快反应速率;D中也是原电池原理,答案选B。

 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案【题目】热化学和各类平衡等都是化学研究的对象
(1)已知:①2O2(g)+N2(g)==N2O4(l) △H1;
②N2(g)+2H2(g)==N2H4(g) △H2;
③O2(g)+2H2(g)==2H2O(g) △H3;
④2N2H4(g) +N2O4(1)==3N2(g)+4H2O(g) △H4。
上述反成热效应之间的关系式为△H4 =_______(用含△H1、△H2、△H3的代数式表示)。
(2)将不同量的H2O(g)和CO(g)分别通入体积为2L的恒容密闭容器中,进行反应:H2O(g)+CO(g) ![]() H2(g)+CO2(g),得到如下表三组数据:
H2(g)+CO2(g),得到如下表三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡 所需时间/min | ||
H2O | CO | H2 | CO | |||
1 | 800 | 2 | 4 | 4/3 | 8/3 | 6 |
2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
3 | 900 | a | b | c | d | t |
①该反应的逆反应为______(填“吸热”或“放热”)反应;实验2的平衡常数K=________。
②若实验3达到平衡时与实验2达到平衡状态时各物质的体积分数分别相等,且t<3,则a、b应满足的关系是_______(用含a、b的代数式表示)。
③若保持温度和容积不变,向实验1再增加4molH2O(g),使反应达到新的平衡。下列说法不正确的是______(填序号)。
A.新、旧平衡时容器内气体的压强之比是5 : 3
B.新平衡时H2O的转化率增大
C.新平衡时CO的浓度是0.8 mol·L-l
D.新、旧平衡时容器内气体密度之比为5 : 3
(3)室温下,用0.1 mol·L-l的KOH溶液滴定10.00Ml0.10 mol·L-l H2C2O4 (二元弱酸)溶液,所得滴定曲线如图(混合溶液的体积可看成混合前溶液的体积之和)。请回答下列问题:
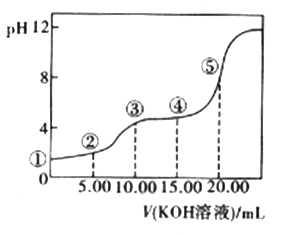
a.点②所示溶液中的电荷守恒式为________________________。
b.点③所示溶液中所有离子的浓度由大到小的顺序为___________________。
c.成④所示溶液中c(K+)+c(H2C2O4)+c(HC2O4-)+c(C2O42-)=________mol/L。